Ежик из ватных палочек: Ёжик с мягкими иголками — Поделки из подручных материалов, Животные, для детей от 5 лет
Ёжик с мягкими иголками — Поделки из подручных материалов, Животные, для детей от 5 лет
Оптимальный возраст:
Десткая поделка самого милого и безопасного ёжика, которого вы только могли когда-то повстречать, ведь его иголки сделаны из мягких ватных палочек. Пошаговая инструкция, что представлена на странице, поможет вам с легкостью повторить все этапы и создать лесного жителя.
Для ёжика нам понадобится:
- Цветная бумага
- Ножицы
- Ватные палочки
- Пластилин
Приступим:
- Разрезаем подготовленные ватные палочки пополам, штучек 10-15.
- Из зелёной бумаги вырезаем небольшой листик с дерева, на котором устроится наш ежик.
- Затем переходим к пластилину, и лепим большой и очень маленький шарик черного цвета, два белых шарика и один выгнутый треугольник оранжевого цвета, как видно все детали на фото.
- Приклеим треугольник с одной стороны чёрного шара и ставим нашего будущего ёжика на листочек.

- Добавляем глаза и носик.
- Вставляем на спинку нашего ёжика множество ватных палочек, мягкой стороной вверх.
Сделать Ежика можно не только таким способом, но и из осенних листьев, крупы, бумаги и даже техникой паперкарфт, где поделки и аппликации представлены для детей разных возрастов в садик или школу.
Для ёжика нам понадобится:
Цветная бумага
Ножицы
Ватные палочки
Пластилин
Разрезаем подготовленные ватные палочки пополам, штучек 10-15.
Из зелёной бумаги вырезаем небольшой листик с дерева, на котором устроится наш ежик.
Затем переходим к пластилину, и лепим большой и очень маленький шарик черного цвета, два белых шарика и один выгнутый треугольник оранжевого цвета, как видно все детали на фото.
Приклеим треугольник с одной стороны чёрного шара и ставим нашего будущего ёжика на листочек.
Добавляем глаза и носик.
Вставляем на спинку нашего ёжика множество ватных палочек, мягкой стороной вверх.
Сделать Ежика можно не только таким способом, но и из осенних листьев, крупы, бумаги и даже техникой паперкарфт, где поделки и аппликации представлены для детей разных возрастов в садик или школу.
Ромашка из пластилина и ватных палочек
Ежик очень удивился:
Утром луг принарядился!
В нежной травке с белой кашкой
Расцвели цветы ромашки!Л. Золотопут
Хотите сделать быструю поделку по пластилинографии? Ромашка из пластилина подойдет для деток даже самого раннего возраста, а материалы для неё точно найдутся в каждом доме. Если у вас вдруг нет ватных палочек, используйте спички (зубочистки) и ватку.
Ромашку в технике пластилинографии будем делать при помощи техники размазывания. Лучше берите восковой пластилин, он гораздо легче лепится.
Лучше берите восковой пластилин, он гораздо легче лепится.
Чтобы пластилиновая работа сохранилась и радовала вас подольше, ее можно оформить в рамочку или покрыть сверху акриловым лаком.
Материалы:
- лист цветного картона;
- восковой пластилин;
- ватные палочки;
- стеки для лепки.
Как сделать:
1. Возьмите для фона лист цветного картона любого цвета, только не белого.
2. Простым карандашом можно наметить, где у вас будет цветочек.
3. Из зеленого пластилина сделайте стебелек и листики! Приклейте их на фон.
4. На листиках сделайте фактуру при помощи стеков.
5. Из оранжевого ( или желтого) пластилина скатайте шарик, придайте ему форму блинчика. Возьмите ватные палочки, около 10 штук и разрежьте их пополам. Это наши лепестки для ромашки. Вставьте их в середину пластилинового блина.
6. Теперь переверните и прикрепите цветок к стебельку.
7. Скатайте белые шарики пластилина и прикрепите в середину цветока. Сделайте им фактуру при помощи носика карандаша или ручки!
Скатайте белые шарики пластилина и прикрепите в середину цветока. Сделайте им фактуру при помощи носика карандаша или ручки!
Ромашка готова!
Как слепить ромашку из пластилина — краткая инструкция:
Посмотри другие наши поделки:
Не знаете чем занять ребенка? Мы делаем интересные занятия для печати, которые легко и просто скачать и распечатать! Внутри вы найдете раскраски, творческие задания, лабиринты, кроссворды, аппликации и многое другое!
Поделки из ватных палочек
Зимой очень просто найти время, чтобы смастерить с ребенком что-нибудь интересное. Например, долгим зимним вечером можно сделать необычные поделки из ватных палочек. Их очень удобно использовать для самых разных работ.
Самый простой вариант поделки из ватных палочек, своими руками которую сможет сделать даже маленький ребенок – это аппликация. Для создания аппликации из ватных палочек используйте полимерный клей или ПВА.
Достаточно закрепить палочки на листе бумаги определенным образом, чтобы получить красивую картинку:
Поделки из ватных палочек
простые объемные снежинки;
Аппликация снежинка из ватных палочек
снежинки с серединкой из стеклянного камушка;
Снежинка со стеклянным камушкомЯркие снежинки из ватных палочек и камушек
или объемные снежинки;
Украшение на елку из ватных палочек
цветочек, сердцевинка которого сделана из комочка ваты, а стебелек и листик – из синельной проволоки;
Аппликация цветок из ватных палочек
можно сделать композицию из таких цветов;
Цветы из ватных палочек
или праздничный салют;
Салют из ватных палочек
а еще можно превратить палочки в рога рождественского оленя.
Олень из ватных палочек
Если вырезать из картона основу для снежинки, и приклеить к ней ватные палочки, получится красивая подвеска на елку.
Аппликация снежинки из ватных палочек
Такую поделку легко сделать еще более объемной – просто зафиксируйте палочки в комочке белой массы для лепки или пластилина.
При помощи пластилина или застывающей массы для лепки можно сделать и другие поделки:
забавного поросенка;
Поросенок
петушка;
Петушок
овечку.
Овечка
Для этого заранее окрашиваем палочки в нужный цвет. А если вы хотите сделать снеговичка, то и окрашивать палочки не нужно. Посыпьте такого снеговика искусственным снегом – и ваша поделка станет еще интересней.
Снеговик
Можно нарисовать при помощи палочек яркую радугу.
Рисунок ватными палочками
Или сделать милую овечку, приклеив головки палочек к картонным заготовкам. Ножками ее станут старые деревянные бельевые прищепки.
Овечка из ватных палочек
А если у вас нашлись два небольших пенопластовых шарика для творчества, можно превратить их в очаровательного зайчика. Оформляем его головку и тельце половинками ватных палочек, а для создания ушек и лапок используем синельную проволоку. Особый шарм зайчику придаст нос-помпон.
Зайчик из ватных палочек
Из трех пенопластовых шаров большего размера получается очень красивый снеговик. Глазки, нос и рот его мы выкладываем половинками палочек, окрашенными в соответствующий цвет.
Глазки, нос и рот его мы выкладываем половинками палочек, окрашенными в соответствующий цвет.
Материалы для поделкиВтыкаем палочкиСнеговик из ватных палочек
Вот так весело можно провести время, если в вашем распоряжении оказалась небольшая упаковка самых простых ватных палочек!
Поделка Ежик из пластиковой бутылки
2017-07-21
Ежик из пластиковой бутылки
Если в доме накопилось несколько пластиковых бутылок объемом 0,5, 1, 1,5 и 2 л, не спешите их выбрасывать. Пустые бутылки могут стать основой забавных поделок. Смотрите, какого славного и очаровательного добренького ежика мы сегодня с вами сделаем.
Для этого нам понадобится
: маленькая бутылочка от воды и несколько пенопластовых шариков маленького диаметра, канцелярский нож, клеевой пистолет, акриловые краски или гуашь с добавлением ПВА, ватные палочки.
Пошаговая инструкция выполнения работы.
Шаг 1.
Сейчас мы будем делать лапки. Разрезаем канцелярским ножом два пенопластовых шарика пополам, у нас получится четыре лапки.
Шаг 2.
Вырезаем в лапках коготки. Не переживайте, если у вас нет шариков, возьмите и просто наклейте несколько кружочков белого фоамирана, предварительно вырезав на них несколько зубчиков по краю в виде коготков. И не переживайте, что они получатся плоскими, а не полукруглыми, зато проявите смекалку.
Шаг 3.
Теперь возьмемся за ушки. Для этого пенопластовый шарик разрезаем на три части и используем только среднюю, потому что она плоская и круглая. Именно это нам и нужно. Края обрезанного шарика откладываем в сторону. А еще ушки можно сделать немножко по-другому, из обыкновенных монеток, можно сделать из пуговиц, можно также из того же фоамирана.
Шаг 4.
Немного отрезаем от ушка закругленный край для лучшего крепления.
Шаг 5.
Устанавливаем лапки на столе и примеряем, как должна лечь на низ бутылочка. После этого приклеиваем на лапки бутылку-тельце. Благодаря тому, что бутылка еще не покрашена, видно места крепления лапок. Те, кто уже делал подобные игрушки, знает, как сложно бывает равномерно распределить эти ножки так, чтобы животное стояло правильно.
Шаг 6.
Приклеиваем ушки. Основная заготовка готова.
Шаг 7.
Раскрашиваем мордочку и животик в нежно-розовый цвет. Краску нужно положить в два слоя, чтобы цвет лег равномерно и пластик бутылки не просвечивался.
Шаг 8.
Заливаем насыщено белую краску внутрь бутылочки, закрываем крышкой и взбалтываем, окрашивая ежика в белый цвет изнутри. Лишнюю краску выливаем. Бутылку оставляем открытой.
Шаг 9.
Черной краской красим края ушек, лапок. Носик полностью покрываем черной краской. Оставляем сушиться.
Шаг 10.
Теперь делаем грибы. Приклеиваем пенопластовые шарики к широкой пластмассовой трубочке с двух сторон.
Шаг 11.
Отрезаем шарик, немного отступив от поверхности трубочки.
Шаг 12.
Отрезаем одну ножку, затем вторую. На ножках получились своеобразные пенопластовые пробки с одной стороны. Одну ножку делаем немного короче другой.
Шаг 13.
Ножки грибочков красим в белый цвет. Чтобы детали высохли и не приклеились к столу, сушить их нужно в подвешенном состоянии. Для этого отлично подойдет кусок пенопласта и зубочистки. Кладем пенопласт на стол, вкалываем в него зубочистки, а на них надеваем покрашенные ножки.
Шаг 14.
На срезанной части шарика-грибочка делаем небольшое углубление. Насаживаем шляпку на зубочистку и раскрашиваем низ шляпки в желтый цвет. Верхнюю часть гриба красим коричневой краской. Вставляем зубочистки в пенопласт для высыхания краски.
Вставляем зубочистки в пенопласт для высыхания краски.
Шаг 15.
Приступим к иголкам. Для этого воспользуемся ватными палочками. Обрезаем ватные кончики, слегка окрашиваем их черной краской, даем высохнуть. Затем приклеим иголки к спине ежика. Сначала наносим несколько точек клея клеевым пистолетом, затем прикрепляем к ним иголки. Снова ставим несколько клеевых точек, снова прикрепляем к ним ватные головки и т.д., пока не заполним иголками все тело ежика.
Шаг 16.
Приклеиваем глазки. Мы используем уже готовые, но вы можете сделать их самостоятельно из бумаги. Маркером рисуем маленькие бровки и не забываем об улыбке, ведь у нас добрый ежик.
Шаг 17.
Приклеиваем шляпки грибочков к ножкам. И уже целые грибы прикрепляем к спине ежика.
Назначеные фильтры
Навык
- Чувство цвета
- Фантазия
- Словарный запас
- Развитие речи
- Пространственное восприятие
- Память
- Мелкая моторика
- Логика
- Координация
- Воображение
Способности
- Учебные и творческие
- Уникальные
- Физические
- Художественно-изобразительные
- Литературные
- Музыкальные
- Конструктивно-технические
- Математические
- Умственные и специальные
Галерея картинок
Похожие статьи
Поделки из ватных дисков.
 Много идей своими руками для детей
Много идей своими руками для детей
Часто совершенно обычным вещам можно найти необычное применение. И я предлагаю вам по-новому посмотреть на окружающие вас предметы. Для этого просто понаблюдайте за детьми, уж они то точно по своему используют все, что их окружает.
А, если вам повезло, и вы стали мамой или папой, то поверьте самые простые бытовые вещи могут занять ребенка дольше, чем покупные игрушки. Сегодня я предложу вам и деткам сделать поделки из ватных дисков. Этот материал можно использовать и для годовалые малышей и для школьников. Отличаться будет только уровень сложности творческой работы.
Чтобы сделать работу более яркой и красочной, мы возьмем еще и краски, бумагу, ножницы и клей. Если у вас где-то под рукой есть немного декоративных пуговиц, пайеток или бусин, то смело берите их в оборот.
Все идеи я разделила по временам года, так мы рассмотрим весенние и зимние варианты для творчества.
Поделки из ватных дисков и палочек для детей 3-4 лет
Для малышей подбираются самые простые задания. Чаще всего делаем солнышко, цветочки или животных. Я подобрала несколько идей, где можно разнообразить поделку ватными палочками.
Чаще всего делаем солнышко, цветочки или животных. Я подобрала несколько идей, где можно разнообразить поделку ватными палочками.
Мы с ребенком все изделия фиксируем на клей ПВА. Он считается самым безвредным и используется также в ясельных группах детских садов.
Давайте начнем с такого позитивного солнышка! Идея интересна тем, что ее можно держать за трубочку. Ведь это так интересно бегать и показывать что-то необычное бабуле и дедуле.
С дочкой мы делали волшебную палочку, которая получилась очень похожа на это солнце.
теперь рассмотрим ромашки. Сначала на основу клеим ватные диски, которые малыш раскрашивает в желтый цвет. Мы же в это время отрезаем кончики и палочек.
Для этой поделки нужна помощь взрослого, потому что детки еще не могут очень ровно выкладывать элементы по линии.
Подобный вариант, но серединка приклеивается поверх ватных палочек.
Милая бабочка, которую можно раскрашивать в разные цвета акварельными красками.
На очереди милая овечка. Посмотрите, как эстетично она выглядит.
Сначала из бумаги вырезаем основу для туловища и головы. Посмотрите, что большая деталь имеет продолговатую форму, а меньшая — чуть вытянутую, похожую на грушу.
Взрослый отрезает кончики у палочек. Берите самый дешевый продукт. У него, как правило, производителя жалеют материала и палочки будут отрезаться легко.
Приклеиваем на клей ПВА ушки и челочку.
Рисуем глазки и носик.
И выкладывая ряд за рядом приклеиваем шубу. Ребенку самостоятельно это сделать сложно, но очень интересно. Поэтому будьте рядом и подсказывайте куда нужно клеить следующую деталь.
Мы же с малышкой выкладывали кончики по очереди, так я смогла сохранить ряды ровными.
На обратную сторону зафиксируйте прищепки. Они могут быть не только деревянные, но и цветные пластмассовые.
Теперь варианты попроще. Например смастерить подвесы «День и ночь». Эту идею использовала знакомая молодая мамочка, когда шила мобиль для своего сыночка.
Эту идею использовала знакомая молодая мамочка, когда шила мобиль для своего сыночка.
Оригинальная поделка из пластилина с мягкими ватными облаками. Заодно и последовательность цветов выучите.
Скажу честно, моей дочке долго не покорялось умение катать «колбаску» из пластилина. Но все же к последнему седьмому цвету, мы это дело осилили.
Понаблюдайте за своим малышом легко ли он владеет своими ручками или нужно больше времени уделять развитию мелкой моторики.
Очень красивый и простой барашек. Ушко сделали из фетра, но можно использовать самоклеящуюся бумагу.
Тадам! А теперь самая любимая в нашей семье аппликация — мороженка. Такие снежинки я покупала в магазине текстиля еще к прошлому Новому году, но и здесь пригодились. Только наша поделка не сохранилась, поэтому привожу очень похожую.
Можно по-разному выкладывать шарики. Именно этим такая мороженка нас и покорила. Каждый раз новая поделка.
Все детки обожают кисок. Эти милые создания просто делаются из 3 ватных дисков. Для экономии я каждый из них разделяю на две половинки.
Также ребятишки оценят эту ромашку. Глазки и ротик можно просто нарисовать фломастером.
Склеить гусеничку смогут даже трехлетки без участия мамы.
Такого мишку лучше предложить ребенку от 4 лет. Потому что используются очень мелкие детали, которые наклеиваются поверх основных и создают объем.
О, домик из цветной бумаги и мягкого снега.
Еще вариант гусеницы, раскрашенной в разные цвета.
эти барашки похожи на персонажей из мультика «Смешарики», там все кругленькие и с ножками))). Рога сверните из бумаги или пластилина.
Забавный петушок понравится любителям ярких цветов. Для облегчения задачи, предложите ребенку сначала раскрасить диски в нужные цвета, высушить их. И только после этого приступать к творчеству.
Это лисичка, которая съела колобка. Кстати, его тоже можно добавить на эту поделку и получится сюжет из сказки.
Кстати, его тоже можно добавить на эту поделку и получится сюжет из сказки.
божьи коровки — это одни из первых насекомых, с которыми мы знакомим наших деток. Они абсолютно безвредны и таинственны. И ведь всем так интересно узнать, сколько же исполнилось годиков каждой букашке (заодно и счет до десяти с мамой повторим).
Пингвинов в нашей стране любят. Потому что эти птички забавно передвигаются. Предложите малышу освоить ножницы, разрезав диски пополам. А потом вместе соберете эту поделку.
Здесь не хватает Ниф-Нифа., но его же можно легко добавить. Еще предлагаю усложнить аппликацию и скатать из пластилина травку.
К трем годам пора знакомить ребенка с окружающим миром. Мы это начали с изучения птичек. Ведь легко показать разницу между снегирем и синицей. Чтобы закрепить понимание, сделайте такую зимнюю птичку.
Эта идея сложная, но с помощью взрослых вполне осуществимая. Сложность заключается в придании ватному диску формы лап и головы. Поэтому наберитесь терпения и заранее подготовьте эти детали.А сам сюжет очень похож из сказки по умного белого медвежонка Умку.
Поэтому наберитесь терпения и заранее подготовьте эти детали.А сам сюжет очень похож из сказки по умного белого медвежонка Умку.
Вот такие варианты для дошкольников я подобрала. Здесь есть очень простые варианты, а есть посложнее. Это важно, потому что с более сложными поделками ребенок развивается быстрее.
Весенние цветы к 8 марта с описанием
Поделки на весеннюю тему обязательно присутствует в садиковской и школьной программах. И в самый последний момент делаются в семейном кругу в 12 часов ночи. Знаем, проходили!
Поэтому я предложу вам на подобные случаи выход — свернуть цветочки из ватных дисков. Материал доступный, есть в каждом доме и создать из него композицию довольно просто. Однако смотреться она будет богаче, чем такая же, но из бумаги.
Также данные цветочки можно создать в качестве подарка маме или бабушке на 8 марта. Ведь в Международный Женский день принято дарить букеты. Поэтому дайте ребенку возможность самовыражения.
Начнем мы наше творчество с создания таких роз.
Их можно использовать для топиария. По данной технике легко получаются как бутоны, так и открытые цветы.
Нам понадобится:
- Клей ПВА
- Ватные диски
- Краски
Берем диск, по краю наносим клей. Сворачиваем круг пополам — вторая сторона должна приклеиться. Теперь эту деталь смазываем с двух сторон.
И начинаем сворачивать заготовку в рулончик. У нас получилась серединка.
Теперь начинаем делать лепесточки. Также смазываем один край и склеиваем диск пополам. Промазываем клеем обе стороны и торец. И накладываем ее на серединку.
Главное, хорошо проклеить края и пальцами убрать все ворсинки.
Повторяем процесс создания лепестков еще на 5 дисках.
А если загибать заготовку не пополам, а на 1/4 часть, то получится бутон.
Теперь посмотрите, как эти заготовки можно собрать в композиции.
Вот такая мягкая открытка.
Презент маме или второй половинке на 14 февраля.
А вот и топиарий с цветочным оформление.
Теперь перейдем к созданию ромашки.
Нам понадобится:
- Цветная бумага
- Клей карандаш
- Ватные диски
- Одна трубочка для коктейля
Делаем заготовки:
- Вырезаем круг из листа зеленого цвета диаметром 8 см.
- Полоску с размерами 20*6 см и листочек произвольной формы.
- Из желтого диска вырезаем круглую деталь диаметром 4 см.
- Листочек произвольной формы
Берем соломинку и прямоугольник зеленого цвета. Который будем наматывать на палочку. Чтобы бумага держалась, промажем края клеем.
Теперь соломинку кладем с одного края и оборачиваем бумагу вокруг нее.
Готовый стебель с одного края надрежем на 1 см. Таких надрезов нам нужно 4.
И загибаем их.
Берем большую круглую зеленую заготовку. Делаем разрез до середины, в которой мы вырезаем дырочку. В нее и вставим нашу палочку.
В нее и вставим нашу палочку.
Один край смажем клеем и на нее приклеем другую сторону. Получается чашечка.
В серединку чашечки проталкиваем стебелек. И промазывая заранее сделанные надрезы приклеиваем их к кругу. Вот основание для ромашки и готово.
Теперь на него наклеиваем ватные диски. Внимание: нам нужно это делать внахлест, чтобы поместилось 4 лепестка.
На них приклеиваем желтую основу. И осталось только зафиксировать листик.
Еще я нашла другой вариант создания лепестков. Стебель и чашечку изготавливаем по этому же принципу. Но диски заворачиваем по-другому.
Два края промазываем клеем ПВА и загибаем внутрь.
Получится вот так.
Заворачиваем остальные лепестки и собираем цветок. А он получается вот таким!
Вы можете сделать несколько ромашек и из них собрать букет.
Идея с серединкой из пластмассовой крышечки.
Вариант для самых маленьких, когда в качестве лепестков выступают надрезы. Серединку заклеим пластилином.
Серединку заклеим пластилином.
Самый весенний цветок — подснежник. Он может быть разным.
Еще вариант букета.
Из рельефных ватных дисков получаются красивые лепесточки. Например, как у этого нарцисса.
Майские солнечные цветочки — одуванчики. Делаются очень быстро, а смотрятся, как настоящие.
Чтобы придать реалистичности клейте не целый диск, а одну сторону ватой наружу.
А здесь они еще желтые.
Еще подобная композиция с листочками из бумаги.
На этой фотографии хорошо видно, что диски разделены. На высоком цветочке даже просвечивает стебелек. Кажется, что головка очень воздушная и невесомая.
А еще мне понравилась композиция для домашнего декора в этом видео.
Цветочки тоже мягкие и не совсем привычные. Думаю, что вам также понравится эта идея.
Оригинальные идеи на зимнюю тему (к Новому году)
На весеннюю тему поговорили, приступим к зимней. Конечно, здесь мы делаем все, что относится к снегу и новому году. Первой в голову приходит идея изобразить снеговиков, ведь наш расходный материал уже круглый!
А можно придать дискам разные размеры и получится такой милаха.
Вариант с забавной метелкой.
Еще необычно сделана елочка. Посмотрите, как она оригинально смотрится.
Обратите внимание, насколько аккуратнее выглядят качественные прошитые диски. Нигде нет лишних ворсинок.
А здесь целая композиция!
Также идея с ватой. Ножки можно заменить нитяными помпонами. Получится поделка, выполненная в разных техниках.
Теперь давайте узнаем, как можно сделать Деда Мороза.
Еще аппликация с пластилином и фетровыми снежинками.
Забавные подвесы из которых можно сделать гирлянду. Мы сотворили такого морозика в прошлый праздник и клали его под елку.
А этот вообще очень необычный и забавный! Выступает в качестве новогодней игрушки.
Давайте перейдем к елочкам.
В качестве украшения возьмем бусины или пластилиновые шарики.
Сами игрушки могут быть тоже из ваты.
Или такими.
Зимняя птичка всегда сопровождает вьюгу и метель. Поэтому без снегиря зимняя тема будет не полной.
Деревья в шубе и снежные шапки на крышах домов.
Детки создают целые панорамы.
Очень много идей для творчества, думаю, что одной пачкой ватных дисков вы просто так не отделаетесь))
Делаем цыплят в детский сад для детей 5-6 лет
Почему-то цыплятки у меня ассоциируются с Пасхой. Обычно к этому празднику мы подготавливаем этих желтокрылых. Но, конечно, можно данный вид поделки не привязывать ни к какому празднику, а просто провести время с малышами за полезным занятием.
Вот уж проще не придумать. Подойдет и для самых маленьких.
Увидели из чего сделаны бантики? Да, вы правы — из макарон! Используем все, что есть под рукой!
Одноразовая посуда тоже подойдет.
А как вам эти кругляши? Яркие, солнечные и легкие в выполнении.
Думаю, что это все же утенок, ведь цыпочки не плавают. Но он отлично вписывается в нашу тему.
Из пластилина сделайте недостающие детали и покормите своего цыпу пшеном или зернышками.
Для подставки используют шпажки для шашлычков. С такими фигурками интересно играть в кукольный театр.
Любая из этих поделок может стать поздравительной открыткой, если свернуть основу пополам и написать пожелания внутри.
Как сделать поделки из ватных дисков к 23 февраля
Февраль тоже зимний месяц, но я выделила данную тему отдельно, чтобы показать, как можно поздравить наших мужчин с этим праздником. На самом деле, идей не так уж и много. Но при известной доле фантазии, их можно додумать.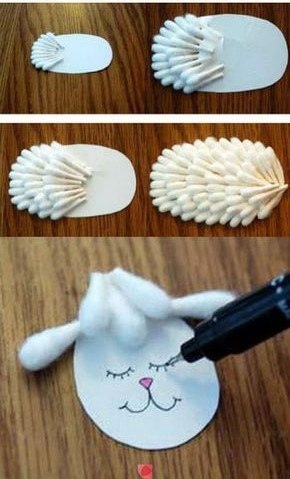
Если ваш папа не имеет отношение к армии, то сделайте подобный вариант с пандочкой.
А, уж для служивых подойдет открытка с танком и ватными облаками.
Если у вас есть идеи на данную тему, то присылайте.
Оригинальные идеи для творчества с детьми начальной школы (8,9 лет)
Школьники могут делать более сложные поделки. И не обязательно это будут объемные цветы. Сегодня я предложу вам за пять минут изготовить ангелочков. Они могут стать самостоятельным украшением на Рождество или на елку. Но и стать оберегом на день рождения или именины.
Понадобится:
- Клей
- Ватные диски
- Нитки
- Краски
- Зубочистка
Берем ватный диск и раскрываем его.
Внутрь кладем вату, бусину или другой диск, чтобы получилась объемную головку.
Ниточкой фиксируем. Края можно сделать рельефными.
Расправляем крылышки.
Теперь подготавливаем юбочку. Заворачиваем края внутрь и фиксируем их клеем.
В серединку вставьте зубочистку.
Теперь в центр крылышек с головкой приклеим юбочку.
Осталось только украсить ангелочка красками или пайетками.
Диски для поделок лучше приобрести более качественные, есть даже с прошитым краем. Так они не развалятся при творчестве. И не испортят внешний вид аппликации неаккуратными махнушками.
Очень интересный аист на ножке из пушистой проволоки. Надо же было придумать такого милаху!
Или вот такой простой барашек. Минимум материала — максимум вкуса.
Беленький и пушистый зайчонок тоже понравится многим.
А здесь целая композиция с лебедями. Посмотрите, они ведь очень похожи на настоящих.
На этой картинке котятки, которые греются на солнышке.
Оригинальный аист. Думаю, что у его автора есть творческий потенциал.
Можно сделать льва.
Или петушка. Но не хочется, чтобы он был не раскрашенный.
А вот и ежик. Из половинок ватного диска можно сделать грибочки и уложить их на иголки.
Из половинок ватного диска можно сделать грибочки и уложить их на иголки.
Также касатки и рыбки могут быть подогнаны под круглую форму материала.
Объемные каллы своими руками
Еще меня покорила идея белоснежных каллов. Это цветы имеющие один большой белый лепесток и желтый пестик. А у нас же есть все необходимые материалы, чтобы повторить такую неприхотливую форму.
Нам понадобится:
- Клей ПВА
- Ватные диски
- Ватные палочки
- Желтая гуашь
- Трубочки для коктейля
Первым делом окрашиваем кончики палочек в желтой гуаши и сушим. Затем берем одну штучку и вокруг нее заворачиваем диск. Края хорошо фиксируем ПВА.
Второй конец вставляем в трубочку. Осталось только приклеить лепестки и задекорировать все неаккуратные стыки.
В этой же технике можно выполнить подарочные корзинки.
Или композиции на бумажных ажурных салфетках.
А здесь каллы покрашены гуашью. Букетик смотрится очень ярко.
Букетик смотрится очень ярко.
Мои дорогие, идей очень много. Я с радостью делала эту подборку, потому что знаю. Кому-то она обязательно пригодится.
Поделки из ватных палочек, дисков, пластилина своими руками
Несложные поделки, созданные из ватных палочек и дисков, — это не только интересное развлечение для детей, но и эффектный и быстрый способ украсить подарок, сделать игрушку для малыша или создать оригинальную открытку к любому празднику.
Инструменты и подручные средства
Для того, чтобы начать творить из ватных палочек и ватных дисков, нужен минимальный набор инструментов и материалов. Для поделок лучше выбрать недорогие ватные палочки, так как пластик у таких марок тоньше и его легче резать.
Ватные диски лучше взять с узором (принтом, напоминающим прострочку). Такие диски легче резать, они меньше слоятся, их удобнее красить, и они лучше держат форму. Для работы с палочками так же понадобится клей-карандаш или густой клей ПВА, а для работы с ватными дисками можно ещё взять клеевой пистолет.
Общие рекомендации по работе
Поделки из ватных палочек принесут удовольствие, если знаешь, как грамотно фиксировать палочки.
Этот процесс требует соблюдения нескольких правил:
- Если нужно приклеить палочки по одной, точечно, то можно намазать ватную сторону. В остальных случаях, если нужно закрепить сразу несколько палочек, удобнее нанести клей на основу, так как она меньше его впитывает.
- Ватные палочки сразу не прилипнут к основе, их нужно очень хорошо прижать, подержать 10-15 с, а потом положить под пресс.
- Белый клей-карандаш, если сделать жирную промазку, клеит ватные палочки к картону лучше, чем ПВА. С клеем ПВА изделие приходится очень надолго класть под пресс или выбирать очень густой клей. Для совсем маленьких детей в любой поделке клей можно заменить на пластилин соответствующего оттенка.
Что касается ватных дисков, по технологии цветы и другие поделки из этого материала напоминают аналогичные произведения из фетра и флиса. Однако существует разница, связанная с использованием поделок. Для изготовления цветов из фетра берут только термоклей или нитки, они достаточно долговечны, поэтому часто используются для украшения одежды и разных аксессуаров (сумок, заколок).
Однако существует разница, связанная с использованием поделок. Для изготовления цветов из фетра берут только термоклей или нитки, они достаточно долговечны, поэтому часто используются для украшения одежды и разных аксессуаров (сумок, заколок).
Один из способов окрашивания ватных дисков или палочек для изготовления поделок — погружение в краситель
Цветы из ватных дисков не обладают такой износостойкостью, от частых прикосновений они быстро могут прийти в негодность. Плюс, ватные цветы полностью теряют форму при намокании. Ещё они могут пачкаться, так как их приходится красить гуашью или акварелью.
Таким образом, эффектные цветы из ватных дисков и палочек можно использовать только для украшения и декора ограниченного числа предметов, и срок их службы недолог. С помощью таких цветов можно создать открытку, картину, поздравительный плакат, украсить ими подарок или маскарадный костюм. Для фиксирования лепестков используют термоклей (не подходит для детей) или очень густой ПВА.
Окрашивать ватные диски и палочки можно двумя способами:
- Погрузить их в раствор с растворённым красителем и аккуратно отжать.

- Наносить краску с помощью широкой кисти примакиванием, на кисточке должно быть достаточно воды.
В обоих случаях можно использовать акварель, гуашь или пищевые красители.
Поделки из ватных палочек на плоскости – 10 интересных идей
Использование ватных палочек для аппликаций и поделок на плоскости позволяет добавить изделию объём и рельеф – например, воспроизвести фактуру шерсти и снега.
Поделка выполняется очень быстро, а результат получается очень оригинальным. В этой технике можно сделать картину на стену, игрушку для кукольного театра, открытку.
Мастер-класс – поделка с использованием ватных палочек «Лев»
Занятие можно начать с отрывка из стихотворения С.Я. Маршака «Львята»:
Вы разве не знаете папы —
Большого, рыжего льва?
У него тяжелые лапы
И косматая голова.
Далее можно показать вырезанного из картона льва. С детьми следует обсудить, почему у него «косматая голова», что у льва на голове (грива). Дальше можно обдумать, с помощью каких материалов сделать гриву «косматой» — вата, ватные палочки, ватные диски, нитки, шерсть, бумага.
Дальше можно обдумать, с помощью каких материалов сделать гриву «косматой» — вата, ватные палочки, ватные диски, нитки, шерсть, бумага.
Инструменты и материалы:
- Ватные палочки – больше 15 штук.
- Ножницы.
- Клей-карандаш, клей ПВА или жёлтый пластилин.
- Краски (акварельные или гуашь), кисточка.
- Ножницы.
Процесс выполнения:
- Вначале нужно нарисовать на жёлтом картоне и вырезать изображение льва с гривой. Дети 3 – 5 лет получают готовую картинку.
- Далее происходит подготовка ватных палочек, для поделки потребуется не менее 30 ватных хвостиков. Их нужно отрезать.
- На следующем этапе намазывают частями гриву льва и приклеивают палочки по кругу. Не нужно намазывать сразу всё, так как клей высыхает. Каждую палочку нужно прижать пальцем на 5 с. Дети 3 – 5 лет могут приклеивать ватки на расстоянии, чтобы работа не была слишком долгой и утомительной. На кисточку хвоста тоже можно прикрепить ватные палочки.

- Когда все области заполнены, изделие нужно положить под пресс на 10-15 мин.
- Далее палочки раскрашивают, чередуя жёлтый, оранжевый и коричневый цвета. Получается пёстрая грива. С детьми нужно повторить, что кисть нужно просто прижимать к ватным палочкам.
Очень часто данное занятие мотивирует сделать льва и в других техниках, например, с гривой из ваты или ватных дисков. Опираясь на данный мастер-класс, можно создать и другие поделки (животных, растения).
Пудель
Процесс работы:
- Вначале вырезают изображение большого пуделя.
- Обрезают ватные наконечники от 10-12 ватных палочек.
- Наклеивают ватные хвостики в зону хохолка, холки, делают шары на хвосте и ногах.
- Если пудель белый, его не раскрашивают, если чёрный или абрикосовый, ватные палочки тонируют соответствующим цветом.
Лошадка
Ход работы:
- Подбирают изображение лошади, вырезают его.
- Обрезают верхушки с 12 – 15 ватных палочек.

- Наносят клей на гриву и хвост, приклеивают палочки и кладут лошадку под пресс.
- Тонируют палочки гуашью или акварелью.
Цыплёнок
Ход работы:
- На 1 этапе вырезают овальный шаблон, также готовят красный клюв и белые кружки для глаз.
- Дальше обрезают вату с 10-20 ватных палочек, это зависит от размера цыплёнка.
- Наносят клей на овальную основу жирным слоем и фиксируют палочки по кругу, прижимая каждую на 5 с. Сверху прикрепляют вертикально 3 палочки для хохолка, по бокам по 3 палочки для крыльев, снизу 6 палочек для лапок.
- На следующем этапе нужно обязательно положить поделку под пресс.
- После этого покрасить палочки жёлтым цветом, лапки – красным. Рядом можно приклеить скорлупу из ватных дисков.
- На завершающем этапе приклеить глаза и клюв.
Мишка-панда
Ход работы:
- Вырезают тело мишки из картона или рисуют карандашом на листе.
Поделки из ватных палочек — панда
- Обрезают хвостики от 20-25 ватных палочек.

- Наносят клей поэтапно на основу и обклеивают всё тело медведя или только живот ватными валиками.
- Сверху приклеивают картонные или пластиковые глаза и нос.
- Краской наносят характерные чёрные пятна.
Мастер-класс – аппликация с использованием ватных палочек «Зимний пейзаж»
Поделки из ватных палочек и дисков – идеальный вариант того, как можно создать образ зимы с детьми. В начале занятия можно прочитать красивое стихотворение о зиме. Затем расспросить ребёнка, а что похоже на снег (ожидаемые ответы — вата, белая бумага, мука, сахар). Взрослый сообщает, что цель занятия превратить лист картона в зимнюю картину.
Инструменты и материалы:
- 10-12 ватных дисков.
- 20-22 ватные палочки.
- Клей-карандаш, клей ПВА или белый пластилин.
- Белая бумага и бумага пастельных тонов (голубая, розовая, бежевая).
- Голубой или синий картон.
- Маленькие кусочки цветной бумаги (чёрная, красная).

- Ножницы.
- Простой карандаш.
- Груз для пресса.
Процесс выполнения работы:
- В первую очередь на листе основы нужно наметить лёгкими штрихами композицию – где будут расположены домики, сколько их будет, какого они будут размера, где будет снеговик, где деревья.
- Далее необходимо разрезать ватные диски пополам и выложить на листе сугробы волной, потом приклеить сугробы и положить лист под пресс на 5 мин.
- В этот момент следует подготовить палочки для объекта, который будет в середине, например, избушки или домиков. Избушку можно целиком выложить из палочек в виде бревенчатого сруба с окном из белой бумаги сверху, а можно сделать домик из цветной бумаги, а крышу выполнить ватными палочками, как будто на ней лежит снег.
- Затем необходимо приклеить палочки густым клеем ПВА или клеем-карандашом. Для малышей вместо клея можно взять белый пластилин.
- Дальше на основе по очереди выкладывают Снеговика, деревья, забор и другие элементы и приклеивают по той же схеме.

- В небе можно нарисовать белой гуашью снег, или приклеить в некоторых местах крохотные кусочки ваты. Также можно сделать облака и месяц из ватных дисков.
По аналогии с данным мастер-классом, используя те же материалы и технику, можно создать и другие интересные аппликации:
- Аппликация «Весёлый скелет» или «Скелеты динозавров». Ватные палочки идеально подходят для таких поделок, так как повторяют форму костей.
- Аппликация «Снежинка». Ватные палочки позволяют создать на листе бумаги снежинки самых разнообразных узоров и размеров.
Объёмные поделки из ватных палочек
Поделки, которые мастерят из ватных палочек, могут быть не только плоскими, но и объёмными. Такие изделия можно будет использовать как полноценные игрушки или декоративные детали интерьера.
Это будут либо барельефы на плоской основе, либо полностью объёмные поделки.
Во втором случае ватные палочки наклеиваются или втыкаются в разные фигуры, сделанные из пластилина, пенопласта, папье маше, пластиковые контейнеры (например, от киндеров) и мячики.
Мастер-класс – поделка из ватных палочек и дисков «Божья коровка»
Начать занятие можно со стихотворения «Божья коровка, чёрная головка» и показать, как разноцветный жучок на палочке перелетает с места на место. Далее следует спросить, догадываются ли дети, из чего сделана божья коровка.
Инструменты и материалы:
- 1 — 2 ватных диска.
- 6 ватных палочек.
- Краски (акварельные или гуашь).
- 2 кисти (толстая и тонкая).
- Клей ПВА или пластилин.
- Чёрный картон.
- Ножницы.
- Пластиковые глаза или белая бумага и чёрный фломастер.
- Коктейльная трубочка.
Процесс выполнения работы:
- Дети вырезают из чёрного картона кружок, начертив его предварительно по шаблону. Это брюшко божьей коровки. Малышам 2 – 3 лет взрослый выдаёт готовые детали.
- Далее нужно подготовить ножки из ватных палочек – палочки можно разрезать пополам, тогда ноги будут короткие. Или от каждой палочки отрезать ватную часть с одной стороны, а длинный сегмент забрать для лапок.

- На следующем этапе готовят тело и голову – прорезают щель для крыльев и выкраивают голову из того же диска.
- После этого намазывают в центре картонную деталь брюшка клеем довольно жирно, для малышей клей можно заменить колбаской из пластилина, поделка в таком варианте будет менее долговечна, но дети 2-3 лет смогут справиться на этом этапе сами.
- На картон выкладывают лапки или втыкают их в пластилин. Также можно воткнуть в пластилин коктейльную трубочку, чтобы с божьей коровкой можно было путешествовать или вставлять её в цветочный горшок.
- Сверху прижимают лапки ватным диском, на котором прорезаны крылья и добавляют голову на небольшом расстоянии. На какое-то время изделие кладут под пресс.
- Дальше дети раскрашивают крылья красной краской, а ватные палочки лапок и голову – чёрной. Взрослый отдельно обговаривает, что краску кисточкой не размазывают, а как бы промокают кисточку об ватный диск.
- После этого поделке надо дать немного высохнуть, приклеить пластиковые глаза на пластилин или термоклей (с помощью взрослых) и можно с ней играть.

По тому же принципу можно выполнить и другие поделки:
- «Цветик-семицветик» на трубочке. Окрашивать лепестки-палочки в разные цвета можно кисточкой или заранее опустив в краску и высушив.
- «Солнышко» на палочке или верёвочке. Такое солнце из ватного диска и ватных палочек также может быть частью более сложной поделки – подвес «Солнце и облако».
На палочке подвешивается солнце и пушистое облако, собранное из обрезанных ватных палочек, из облака тянутся нити, на которых привязаны кусочки ватных дисков. Это снег. Также можно сделать облако в пару Солнцу из 5 – 6 ватных дисков, скреплённых белым клеем.
Мастер-класс – поделка из ватных палочек «Овечка»
Занятие можно начать со стихотворения «Ты скажи, барашек наш, сколько шерсти ты нам дашь», с загадки про овечку или со сказки «Лиса и овца».
Поделки из ватных палочек — овечка
Материалы и инструменты:
- Ватные палочки – количество зависит от размеров, но не меньше 15 штук.

- Клей-карандаш, клей ПВА или белый пластилин.
- Белый картон.
- Ленточка.
- Чёрный тонкий маркер.
- 2 деревянные ли пластиковые декоративные прищепки.
- Ножницы.
Процесс изготовления:
- Вначале вырезают шаблон тела овечки.
- Готовят ватные палочки, отрезая наконечники.
- Прорисовывают маркером морду овечки.
- Приклеивают на тело и хохолок ватные наконечники от палочек по кругу или в свободном порядке, самый крайний ряд должен выходить за край изделия.
- Можно также оклеить палочками изнаночную сторону, тогда овечка получится совсем объёмной.
- На шею овечке можно завязать ленточку – например, сердечком, тогда овечка может украсить подарок любимому человеку.
- На финальной стадии внизу нужно прикрепить ноги-прищепки, тогда овечка будет стоять. Ещё можно приделать сверху верёвочку, чтобы использовать овцу как подвес для мобиля или ёлочную игрушку.
youtube.com/embed/8FL4a80hShU?wmode=transparent&rel=0&feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Овечку из ватных палочек можно сделать и совсем по другому принципу, используя в качестве основы белый пластилиновый шар или контейнер от киндера. Тогда в пластиковом теле делают отверстия разогретым шилом или иглой, тонируют его в белый цвет, а уже потом втыкают ватные палочки.
По аналогии с «Овечкой» можно сделать и другие поделки – например, зайчика, котёнка или щенка.
Мастер-класс – поделка из ватных палочек для самых маленьких «Ёжик»
Поделки из ватных палочек доступны не только старшим детям и взрослым. Это совсем простое изделие подходит для малышей 1,5 – 2 лет. Начать занятие можно с загадки о ёжике или с рассматривания картинок и определения, где у ёжика нос, лапки, иголки.
Также можно рассказать сказку про Ёжика, которому не нравилось быть колючим и серым, ведь он жил в волшебном лесу, где все дружили и не от кого было защищаться и прятаться, и тогда он пошёл к волшебнице, которая дала ему мягкие иголки и раскрасила их во все цвета радуги.
Инструменты и материалы:
- Тесто для лепки или пластилин.
- Ватные палочки – 10-12 штук.
- Краски (акварельные или гуашь).
- Подставка для лепки.
- Ножницы.
Процесс изготовления:
- Вначале дети лепят тело ёжика – из шара вытягивают носик.
- Потом втыкают иголки из ватных палочек в свободном порядке. Палочки заранее готовит взрослый, обрезая один конец.
- Глаза и нос также делают из кончиков палочек.
- Иголки раскрашивают коричневым или всеми цветами радуги. Глаза и нос – чёрным.
По тому же принципу можно создать и другие поделки:
- «Объёмные снежинки». Можно взять белый пластилиновый шарик или обклеить его фольгой. В шарик втыкают лучики снежинки. С помощью маленьких пластилиновых шариков можно сделать сочленения.
- «Фантастические цветы». В шаре из тонкого пластика сделать разогретым шилом или иглой отверстия, в них вставить ватные диски и тонировать краской.
 Стебли можно сделать из проволоки и изогнуть их причудливым образом.
Стебли можно сделать из проволоки и изогнуть их причудливым образом.
Цветы из ватных дисков и палочек – 5 красивых вариантов
Поделки из ватных палочек – это не единственный оригинальный способ использовать хозяйственные материалы в творчестве. С помощью цветов из ватных дисков можно быстро и оригинально украсить упаковку подарка, открытку или поздравительный плакат.
Мастер-класс – цветок из ватного диска и палочек «Ромашка»
Данная аппликация идеально подходит для малышей 2-3 лет. Она выполняется за несколько минут, а выглядит очень эффектно.
Материалы и инструменты:
- Ватные диски – 1-2 штуки.
- Ватные палочки – 8 -10 штук.
- Клей-карандаш или ПВА.
- Ножницы.
- Картон.
- Зелёная бумага.
- Краски.
Процесс выполнения:
- В середину приклеивают ватный диск.
- Вокруг делают клеевое кольцо и выкладываю ватные мякиши от палочек.
- Диск закрашивают жёлтым цветом.

- Стебель делают из готовой заготовки или выкладывают из палочек и красят в зелёный цвет.
Мастер-класс – цветы из ватных дисков и палочек «Каллы»
В начале занятия нужно рассмотреть фото живых цветов, проанализировать особенности соцветия.
Инструменты и материалы:
- Ватные диски – 3 штуки.
- Ватные палочки – 3 штуки.
- Краски (акварель или гуашь).
- Ножницы.
- Цветная бумага зелёного оттенка.
- Картон для основы (лучше двусторонний).
- Лента в тон с картоном.
- Клей ПВА или термоклей и клеевой пистолет.
- Коктейльные трубочки зелёного цвета — 3 штуки.
Процесс изготовления:
- Вначале готовят тычинки для цветов, окрашивая ватные палочки с одной стороны в жёлтый цвет.
- Затем краске нужно дать высохнуть, а в этот момент можно подготовить картонную упаковку для букета. Для этого вырезают картонный полукруг, делают волнистый край.
 Сворачивают полукруг трапецией («стаканчиком») и отгибают уголки в стороны. С изнаночной стороны можно закрепить завязки из ленточек.
Сворачивают полукруг трапецией («стаканчиком») и отгибают уголки в стороны. С изнаночной стороны можно закрепить завязки из ленточек. - После этого вставляют ватные палочки (тычинки) в коктейльные палочки (стебельки), они идеально совпадают, ватная сторона служит уплотнителем.
- Ватные диски оборачивают вокруг и закрепляют термоклеем или ПВА. Место крепления (цветоложе) можно покрасить зелёным.
- К трубочкам приклеивают листики из бумаги или дисков.
- Букет из 3-х калл закрепляют внутри конвертика. На задней стенке конверта прорезают по 2 щели для каждого цветка по ширине стебля. Трубочку немного прижимают и закрепляют внутри, хвостики цветов можно обрезать или оставить торчать снаружи.
- Упаковку цветов можно использовать, как открытку для поздравления.
Мастер-класс – цветок из ватных дисков «Нарцисс»
Начать занятие можно с древнегреческого мифа о юноше Нарциссе, в честь которого назван цветок. Также можно рассмотреть фото живого цветка, назвать все его части, возможные цвета.
Инструменты и материалы:
- Ватные диски – 8 штук.
- Ножницы.
- Густой клей ПВА или термоклей и клеевой пистолет.
- Жёлтая акварель или гуашь.
- Цветная бумага зелёного оттенка.
- Картон синего или голубого цвета.
Процесс изготовления:
- За несколько часов до начала работы нужно подготовить материал для тычинок. Взять половинку ватного диска смочить его в воде, в которой размешана жёлтая гуашь или акварель и хорошо отжать. Затем аккуратно разложить для просушки.
- Из ватных дисков вырезать 6 лепестков в форме лодочки, у которой один из краёв немного утолщён, также вырезать круг диаметром 4 см.
- Далее необходимо согнуть все лепестки и хорошо прогладить сгибы.
- На следующем этапе самый край лепестков нужно прищипнуть, склеить с помощью капельки термоклея или густого ПВА, чтобы придать объём. С детьми младшего возраста можно пропустить этот этап.
- Затем проводится сборка цветка на основе из ватного диска.
 Необходимо вначале приклеить три лепестка. Каждый лепесток нужно хорошо прижать у основания и подержать 5 с.
Необходимо вначале приклеить три лепестка. Каждый лепесток нужно хорошо прижать у основания и подержать 5 с.
- Если работа проводится термоклеем, то палец лучше смочить или прижимать изделие специальной лопаткой или другим приспособлением, чтобы избежать попадания клея на кожу. С детьми безопаснее работать густым ПВА, в этом случае изделие лучше собрать прямо на картоне.
- Далее берут половину диска, окрашенного в жёлтый цвет, с округлой стороны делают 5-6 надрезов для тычинок, сворачивают его в трубочку, склеивают. Прикрепляют тычинки в середину соцветия. Также тычинки можно сделать из 3-х наконечников ватных палочек. Если нет времени на покраску диска, сердцевину можно смастерить из жёлтого фетра или желтой хозяйственной салфетки.
- На заключительном этапе вырезают из цветной бумаги стебель и листья и приклеивают. Листья также можно сделать из покрашенных ватных дисков.
Такой нарцисс можно поместить на открытку или сделать картину, использовав в качестве основы одноразовую тарелку.
Мастер-класс – цветок из ватных дисков «Георгин»
Это один из самых эффектных цветов, который можно сделать как из фетра, так и из ватных дисков.
Материалы и инструменты:
- Ватные диски – от 20 штук.
- Густой клей ПВА или термоклей и клеевой пистолет
- Краски.
- Ножницы.
- Линейка.
Процесс изготовления:
- Если георгин должен быть не белым, то ватные диски нужно заранее покрасить, опустив их в воду с разведённой краской.
- Вырезают кружок из ватного диска диаметром 4 см, это основа.
- Затем выкраивают по 9-10 лепестков трёх размеров: 4,5 см, 3,5 см, 2,5 см.
- Лепестки в основании складывают и склеивают с двух сторон, чтобы придать объём.
- Сборку начинают с лепестков самого большого размера, прикрепляют их по кругу к основе, так, чтобы кончики наполовину торчали.
- Следующим рядом внахлёст прикрепляют лепестки меньшего размера, потом самые маленькие.

- В сердцевину можно приклеить тычинки из ватных дисков или пришить бусины.
Мастер-класс – цветок из ватных дисков «Роза»
Этот нежный цветок из ватных дисков, который можно скрутить за несколько минут, дополнит любой подарок.
Материалы и инструменты:
- Ватные диски – 6-7 штук.
- Краски.
- Густой клей ПВА или термоклей и клеевой пистолет.
- Ножницы.
Процесс изготовления:
- Нужно заранее покрасить ватные диски.
- Один из окрашенных дисков свернуть в плотную трубочку и зафиксировать клеем.
- Вокруг этой трубочки обматывать постепенно остальные диски, формируя бутон. Лепестки прикреплять в нижней части клеем.
- В конце работы можно подкрасить края лепестков.
- Для завершения композиции к цветку можно привязать ленту в тон или приклеить листки из ватных дисков.
Изготовление сувениров из ватных палочек и дисков – это такое увлекательное занятие, что, попробовав один раз, захочется придумывать всё новые и новые поделки из этих и других материалов.
Автор: Пичугина Станислава
Видео о поделках из ватных палочек
Поделки из ватных палочек:
Ёлка из ватных палочек
Елка из ватных палочек станет отличным подарком к Новому году, сделанным своими руками.
Серый мир кажется ярким, веселым и необычным, потому что есть люди, которые стараются этот обыденный мир украсить.
Золотые руки — так хвалят тех, кто умеет из самых обычных вещей создать такой шедевр, который поднимет настроение всем вокруг. Таким людям не нужно бегать по магазинам, тратя время на похожие подарки.
В собственной комнате они придумывают и воплощают в реальность самые неожиданные мечты. Казалось бы, ушные палочки уже стали привычным и необходимым средством гигиены.
Но применяемые в медицинских целях, они попали в объектив к людям, которые увидели в них различных зверей, цветы, снежинки, целые сюжеты для картин, даже новогоднюю нарядную елочку.
И оказывается, сложного ничего в этом нет, создать из ушных палочек можно много удивительных сувениров, украшений для декора.
Интересно заняться созданием красивых вещей всей семьей, ведь у детей с детства закладывается интерес к созданию поделок и развивается при этом мелкая моторика, фантазия, воображение.
Оригинальная елка
К новогоднему празднику можно украсить любой уголок квартиры разнообразными сюжетами. Например, панно с нарядной елочкой, которое будет изюминкой-украшением.
Чтобы поделка получилась красивой, необходимо запастись всеми компонентами:
- ватными палочками, количество точно не определить, поэтому лучше запастись несколькими упаковками;
- ватными дисками;
- листом картона выбранного размера;
- кусачками;
- красками и глиттерами;
- блестками серебристого и золотистого оттенков и тонкими ленточками зеленого и белого цветов;
- белым пластилином и клеем ПВА;
- карандашом и кисточкой;
- линейкой, циркулем;
- скрепками, степлером и ножницами.

Елочка, появись! На листе бумаги необходимо отметить границы дерева — нарисовать треугольник.
Пластилин по кусочкам наклеить на картон, причем толщина первого должна соответствовать примерно 2 мм, чтобы палочки могли надежно в нем держаться.
Ватные палочки следует подготовить к работе, отрезав кусачками части с ватой и оставив около 5 мм. Теперь последние должны отправиться в пластилин той частью вверх, где вата. Между элементами практически не должно быть просветов.
Теперь елка из ватных палочек должна выглядеть объемной, в этом поможет ленточка зеленого цвета. Границу пушистой красавицы следует обтянуть, желательно несколько раз, закрепив концы ленты на верхушке красивым бантом или оставив кончики длинными и закрутив с помощью ножниц.
С помощью кисточки и краски пора сделать разноцветные яркие шарики на елке. Да и самой елочке не помешает придать ее природный зеленый цвет.
Когда краска высохнет, на шары нужно нанести разноцветные глиттеры. Если панно прогибается, то с другой стороны с помощью степлера лучше добавить еще один лист картона.
Если панно прогибается, то с другой стороны с помощью степлера лучше добавить еще один лист картона.
Скрепками соединяются верх и низ, а чтобы эти детали не были видны, пригодятся ватные диски, которые делят на 2 кусочка и разрезают, а затем наклеивают внахлест, покрывают клеем, а сверху блестками.
Потом все панно можно покрыть клеем и присыпать мелким бисером под цвет снега или же кокосовой стружкой, манкой.
Новогодние поделки из палочек — это уникальные снежинки, украшения, выполненные из серпантина, атласных лент, фольги, шишек, елочных игрушек. Идей может быть много.
Гости из ватных палочек
Чем можно удивить любимого или собственных детей? Например, смешным ежиком, опять же из ватных палочек.
Что нужно:
- ватные палочки;
- картон;
- краски или фломастеры;
- клей;
- ножницы.
На картоне следует нарисовать туловище и голову. Ватные палочки нужны не целые, а отрезанные наконечники и сама палочка около 5 мм. С помощью клея их аккуратно рядами нужно закреплять на теле.
С помощью клея их аккуратно рядами нужно закреплять на теле.
Голова должна быть с глазками и ротиком. Ее нужно с помощью клея прикрепить к туловищу.
Чтобы ежик был объемным, можно использовать емкость из киндер-сюрприза, куда прячут игрушки. Все действия будут такие же, только в пластмассовом яйце нужно разогретым шилом сделать много дырочек для палочек-иголочек. А в стык вставить маленькую петлю, чтобы было удобно работать.
Отрезанные ушные палочки, прежде чем вставлять в яйцо, нужно смазывать клеем. И так ряд за рядом у ежика появятся иголки.
В торец, который служит для крепления головы, тоже вставить палочку. Когда голова готова, ежику нужно нарисовать глаза и раскрасить иголочки и мордочку.
Таким же способом можно сделать милую овечку: белоснежные палочки идеально подходят для этой поделки.
Сюрпризы к Новому году
Очень страшные поделки из ватных палочек. Детям бывает скучно, даже если они чем-то увлечены, потому научить их создавать разные интересные поделки из обычных палочек для ушей — задача непростая. Можно придумать целую историю, страшную, со скелетами, хищными динозаврами, которые на картинке будут выглядеть весьма устрашающе. А избушка на курьих ножках выполняется очень легко: нужно лишь запастись большим количеством палочек.
Детям бывает скучно, даже если они чем-то увлечены, потому научить их создавать разные интересные поделки из обычных палочек для ушей — задача непростая. Можно придумать целую историю, страшную, со скелетами, хищными динозаврами, которые на картинке будут выглядеть весьма устрашающе. А избушка на курьих ножках выполняется очень легко: нужно лишь запастись большим количеством палочек.
Но не только страшилки могут получаться из этих совсем не приспособленных для мастерства палочек. Картина, на которой красивый уютный домик с забором, скамейкой, солнышком на небе. Ну как не восхититься такой изобретательности!
Веточка вербы для любимой мамы в день 8 Марта не обязательно должна стоять в стакане. Можно преподнести и такой подарок.
Вырезать круг определенного диаметра, пластилином полностью его залепить и сверху вылепить основания и листики, а шапочки вербы сделать из подготовленных ушных палочек, наклеив их. Такую картинку можно закрепить в рамке, тогда она долго будет служить в качестве украшения и доставлять радость маме.
Такую картинку можно закрепить в рамке, тогда она долго будет служить в качестве украшения и доставлять радость маме.
Поделки из ватных палочек могут вызвать много приятных впечатлений. Благодаря им в доме появятся необыкновенные, но такие привычные звери, сказочные растения, забавные картинки. Нужно только суметь по-другому взглянуть на этот мир.
Набор держателей для ватных шариков и тампонов Bunny & Hedgehog: Baby
| Цена: | 36 долларов.85 + Депозит без импортных пошлин и доставка в Российскую Федерацию $ 25,13 Подробности
|
Доступно по более низкой цене у других продавцов, которые могут не предлагать бесплатную доставку Prime.
- В набор входит один (1) держатель для ватных тампонов с изображением ежика и один (1) держатель для ватных шариков с кроликом.
- Каждое изделие изготовлено из качественного керамического керамогранита.
- Держатели имеют длину примерно 4 дюйма
- Идеально подходит для использования в качестве уникального декоративного акцента в ванной комнате.
- Тщательно упакован в удобную коробку для удобного подарка и хранения.
›
См. Дополнительные сведения о продукте
Ребенок держит пластилинового ёжика с расписным косметическим хлопком.. Фотография, картинки, изображения и сток-фотография без роялти. Изображение 5
1.

Ребенок держит пластилинового ёжика с расписной косметической хлопковой рамкой Фотография, картинки, изображения и сток-фотография без роялти. Изображение 5
1.
ребенок держит пластилинового ёжика с нарисованными косметическими ватными тампонами
M
L
XL
Таблица размеров
| Размер изображения | Идеально подходит для |
| S | Интернет и блоги, социальные сети и мобильные приложения. |
| м | Брошюры и каталоги, журналы и открытки. |
| л | Плакаты и баннеры для дома и улицы. |
| XL | Фоны, рекламные щиты и цифровые экраны. |
Используете это изображение на предмете перепродажи или шаблоне?
Распечатать
Электронный
Всесторонний
2706 x 1850 пикселей
|
22. 9 см x
9 см x
15,7 см |
300 точек на дюйм
|
JPG
Масштабирование до любого размера • EPS
2706 x 1850 пикселей
|
22,9 см x
15,7 см |
300 точек на дюйм
|
JPG
Скачать
Купить одно изображение
6 кредитов
Самая низкая цена
с планом подписки
- Попробуйте 1 месяц на 2209 pyб
- Загрузите 10 фотографий или векторов.
- Нет дневного лимита загрузок, неиспользованные загрузки переносятся на следующий месяц
221 pyб
за изображение любой размер
Цена денег
Ключевые слова
Похожие изображения
Нужна помощь? Свяжитесь с вашим персональным менеджером по работе с клиентами
@ +7 499 938-68-54
Мы используем файлы cookie, чтобы вам было удобнее работать. Используя наш веб-сайт, вы соглашаетесь на использование файлов cookie, как описано в нашей Политике использования файлов cookie
Используя наш веб-сайт, вы соглашаетесь на использование файлов cookie, как описано в нашей Политике использования файлов cookie
.
Принимать
Праздники с ежиками
Создание аптечки для рептилий
01 апр, 2021
Вы недавно удочерили рептилию? Если да, то вы отправляетесь в увлекательное и увлекательное путешествие со своим новым питомцем. Мы настоятельно рекомендуем собрать аптечку. Не всегда легко найти круглосуточную клинику для животных, работающую с рептилиями.Возможно, вам придется оказать первую помощь своему маленькому приятелю, чтобы он оставался стабильным, пока вы не попадете к ветеринару. Ветеринар из фермерского отделения штата Техас обсуждает сборку аптечки для рептилий ниже. K it Вы можете найти небольшой прозрачный пластиковый контейнер — самый простой вариант в использовании. Однако вы можете использовать рюкзак или даже сумку для обеда. Ингредиенты Что положить в набор? Дезинфицирующее средство, марля, эластичная повязка, серебряная мазь, хлоргексидин, ватные палочки, депрессор языка, кусачки для ногтей, пинцет, увеличительное стекло, фонарик, бинты, липкая насадка для индейки, бумажные полотенца, скотч для первой помощи, палочки для мороженого, зубочистки, гелевая пена, антипригарные подушечки, кровоостанавливающий порошок, шприцы и не спермицидный лубрикант, например KY. Другие полезные предметы включают одноразовые перчатки, пипетку для глаз, жидкость для промывания глаз, перекись водорода, неоспорин и кусачки. Владельцам ящериц также следует добавить несколько презервативов (не спермицидных), которые пригодятся для перевязки хвостов. Отопление Включите некоторые варианты аварийного нагрева, такие как транспортировочные грелки, тепловые пакеты или бутылки с горячей водой. Они также могут пригодиться при поездках на автомобиле. Просто заверните их в полотенце или трубчатый носок, чтобы ваш домашний динозавр не обгорел. Питание И последнее, но не менее важное: добавьте немного простого Pedialyte на случай обезвоживания вашего питомца, а также некоторые пищевые добавки, включая порошкообразный кальций.Также могут быть полезны пакеты с сахаром. Спросите своего ветеринара за конкретными рекомендациями. Что представляет собой чрезвычайная ситуация? Рептилии могут быть трудными для чтения, особенно для новичков. Некоторые вещи, которые потребуют немедленной помощи, включают проблемы с дыханием, кровавый стул, анорексию, паралич, созерцание звезд, серьезные порезы, переломы костей или раковин, отек, изменение цвета, отравление или подозрение на отравление, удушье и необычные позы или положения.
Другие полезные предметы включают одноразовые перчатки, пипетку для глаз, жидкость для промывания глаз, перекись водорода, неоспорин и кусачки. Владельцам ящериц также следует добавить несколько презервативов (не спермицидных), которые пригодятся для перевязки хвостов. Отопление Включите некоторые варианты аварийного нагрева, такие как транспортировочные грелки, тепловые пакеты или бутылки с горячей водой. Они также могут пригодиться при поездках на автомобиле. Просто заверните их в полотенце или трубчатый носок, чтобы ваш домашний динозавр не обгорел. Питание И последнее, но не менее важное: добавьте немного простого Pedialyte на случай обезвоживания вашего питомца, а также некоторые пищевые добавки, включая порошкообразный кальций.Также могут быть полезны пакеты с сахаром. Спросите своего ветеринара за конкретными рекомендациями. Что представляет собой чрезвычайная ситуация? Рептилии могут быть трудными для чтения, особенно для новичков. Некоторые вещи, которые потребуют немедленной помощи, включают проблемы с дыханием, кровавый стул, анорексию, паралич, созерцание звезд, серьезные порезы, переломы костей или раковин, отек, изменение цвета, отравление или подозрение на отравление, удушье и необычные позы или положения. Тем не менее, для вас важно провести некоторое исследование вашего конкретного типа питомца.Другое В дополнение к перечисленным выше пунктам, мы рекомендуем держать под рукой номер вашего ветеринара, а также номер любой клиники неотложной помощи, находящейся на расстоянии проезжей части, где работают рептилии. Также неплохо распечатать брошюры по оказанию первой помощи. Как ваше местное фермерское отделение, ветеринарная клиника штата Техас, мы здесь, чтобы помочь! Звоните нам в любое время!
Тем не менее, для вас важно провести некоторое исследование вашего конкретного типа питомца.Другое В дополнение к перечисленным выше пунктам, мы рекомендуем держать под рукой номер вашего ветеринара, а также номер любой клиники неотложной помощи, находящейся на расстоянии проезжей части, где работают рептилии. Также неплохо распечатать брошюры по оказанию первой помощи. Как ваше местное фермерское отделение, ветеринарная клиника штата Техас, мы здесь, чтобы помочь! Звоните нам в любое время!
H — это поделка для рукоделия ёжика
H — это ёжик! Помогите своему малышу узнать о букве H, сделав забавную поделку из отпечатков рук ёжика.
Материалы
- Светло-коричневая и темно-коричневая нетоксичная краска
- Чистый лист бумаги
- Бумажная тарелка или макулатура картона
- Ватный шарик
- Ватный тампон или кисть
Инструкции
- Налейте немного светло-коричневой краски на картон.
- Ватным тампоном нанесите тонкий слой светло-коричневой краски на руку ребенка, исключая большой палец.

- Сожмите отпечаток руки вместе пальцами, направив их в сторону на бумагу.
- Смойте краску с руки ребенка.
- Налейте на картон темно-коричневую краску.
- Ватным тампоном нанесите тонкий слой темно-коричневой краски на руку ребенка, исключая большой палец.
- Нажмите на два темно-коричневых отпечатка ладони раскрытыми и направленными вверх пальцами рядом со светло-коричневым отпечатком руки, слегка перекрывая его. При необходимости нанесите краску повторно.
- Смойте краску с руки ребенка.
- С помощью ватного диска нанесите тонкий слой темно-коричневой краски на кончик пальца ребенка.
- Нажмите один темно-коричневый отпечаток пальца в центре светло-коричневого отпечатка руки и четыре темно-коричневых отпечатка пальца под темно-коричневым отпечатком ладони. При необходимости нанесите краску повторно.
- Смойте краску с пальца ребенка.
- С помощью кисти нарисуйте на бумаге темно-коричневую букву «H — это ежик».

Чтобы получить больше удовольствия от поделок с животными, попробуйте мой M Is для ручного отпечатка обезьяны, I Is для ручного отпечатка Ibex, I Is для ручного отпечатка Ibex Craft, C Is для кошачьего отпечатка руки и ремесла с отпечатком следа, C Is для Ремесло с верблюжьей ручкой, H — для рукоделия с лошадью, а Y — для поделки с ручным принтом яка.
Кредиты на изображения
H для рукоделия «Ежик» © 2014 Хизер Джонсон
Светло-коричневая и темно-коричневая акриловая краска © 2014 Хизер Джонсон
Светло-коричневый отпечаток руки с пальцами вместе и без большого пальца © 2014 Хизер Джонсон
Добавление двух темно-коричневых отпечатков ладони Без большого пальца © 2014 Хизер Джонсон,
Добавление пяти темно-коричневых отпечатков пальцев © 2014 Хизер Джонсон,
Готовая H — для поделки с отпечатком руки ежа © 2014 Хизер Джонсон,
Завершенная H — для поделки с отпечатком руки ежа © 2017 Хизер Джонсон
Звуковой сигнал ежа способствует подвижности и инвазивности клеток рака желудка посредством TGF-β-опосредованной активации пути ALK5 – Smad 3 | Канцерогенез
Аннотация
Известно, что активация передачи сигналов hedgehog (Hh) участвует в прогрессировании и инвазии различных опухолей, включая карциному желудка. В этом исследовании мы исследовали влияние передачи сигналов трансформирующего фактора роста (TGF) -β на опосредованную звуком ежа (Shh) инвазию в раковые клетки желудка. Мы обнаружили, что более высокие концентрации N-Shh увеличивают подвижность и инвазивность клеток в раковых клетках желудка, тогда как не наблюдается увеличения в клетках, обработанных KAAD-циклопамином (ингибитор передачи сигналов Shh) или антителами, блокирующими Shh. Кроме того, индуцированная N-Shh миграция и инвазивность клеток рака желудка были уменьшены путем обработки блокирующим антителом против TGF-β или малой интерферирующей РНК (siRNA) TGF-β1 в присутствии N-Shh по сравнению с контрольными группами.Кроме того, секреция TGF-β1, TGF-β-опосредованный транскрипционный ответ, экспрессия белка активин-рецептор-подобной киназы (ALK) 5 и фосфорилирование Smad 3 также усиливались обработкой N-Shh, но не KAAD-циклопамином, анти- Shh или антитела, блокирующие TGF-β1. Блокада киназы ALK5 в присутствии N-Shh значительно ингибировала фосфорилирование Smad 3, активность матриксных металлопротеиназ и Shh-индуцированную подвижность / инвазивность клеток.
В этом исследовании мы исследовали влияние передачи сигналов трансформирующего фактора роста (TGF) -β на опосредованную звуком ежа (Shh) инвазию в раковые клетки желудка. Мы обнаружили, что более высокие концентрации N-Shh увеличивают подвижность и инвазивность клеток в раковых клетках желудка, тогда как не наблюдается увеличения в клетках, обработанных KAAD-циклопамином (ингибитор передачи сигналов Shh) или антителами, блокирующими Shh. Кроме того, индуцированная N-Shh миграция и инвазивность клеток рака желудка были уменьшены путем обработки блокирующим антителом против TGF-β или малой интерферирующей РНК (siRNA) TGF-β1 в присутствии N-Shh по сравнению с контрольными группами.Кроме того, секреция TGF-β1, TGF-β-опосредованный транскрипционный ответ, экспрессия белка активин-рецептор-подобной киназы (ALK) 5 и фосфорилирование Smad 3 также усиливались обработкой N-Shh, но не KAAD-циклопамином, анти- Shh или антитела, блокирующие TGF-β1. Блокада киназы ALK5 в присутствии N-Shh значительно ингибировала фосфорилирование Smad 3, активность матриксных металлопротеиназ и Shh-индуцированную подвижность / инвазивность клеток. Важно отметить, что временная экспрессия миРНК ALK5 или миРНК Smad 3 снижает способность N-Shh стимулировать миграцию и инвазию этих клеток по сравнению с клетками, обработанными неспецифической контрольной миРНК.Таким образом, эти результаты показывают, что Shh способствует подвижности и инвазивности клеток рака желудка посредством TGF-β-опосредованной активации пути ALK5-Smad 3. Кроме того, наши результаты являются первыми, которые предполагают роль и механизм передачи сигналов Shh, поскольку она связана с метастатическим потенциалом рака желудка, тем самым указывая на потенциальные терапевтические молекулярные мишени для уменьшения метастазов.
Важно отметить, что временная экспрессия миРНК ALK5 или миРНК Smad 3 снижает способность N-Shh стимулировать миграцию и инвазию этих клеток по сравнению с клетками, обработанными неспецифической контрольной миРНК.Таким образом, эти результаты показывают, что Shh способствует подвижности и инвазивности клеток рака желудка посредством TGF-β-опосредованной активации пути ALK5-Smad 3. Кроме того, наши результаты являются первыми, которые предполагают роль и механизм передачи сигналов Shh, поскольку она связана с метастатическим потенциалом рака желудка, тем самым указывая на потенциальные терапевтические молекулярные мишени для уменьшения метастазов.
Введение
Путь передачи сигналов hedgehog (Hh) играет критическую роль в организованном росте и дифференцировке клеток во время формирования паттерна эмбриональной ткани; однако он также может участвовать в поддержании компартментов стволовых клеток у взрослых (1–4).Лиганд Hh млекопитающих, sonic hedgehog (Shh), активирует передачу сигналов Hh путем связывания со своим рецептором Patched (Ptch) 1 и 2, чтобы ослабить репрессию Ptch Smoothened (Smo), который является мембранным белком, связанным с рецепторами, связанными с G-белками . После активации Smo способствует ядерной транслокации семейства транскрипционных факторов Ci в Drosophila и Glis (Gli1, Gli2 и Gli3) у позвоночных в активные гены-мишени Hh (3, 5). Различные виды рака у человека вызываются мутациями, которые приводят к несоответствующей активации пути Hh.Например, мутации избыточной активации в гене Smo и мутации потери функции в гене ptch вызывают большинство случаев рака человека и мыши (6, 7), а также ингибирование этого пути с помощью антител, блокирующих лиганд. или ингибитор Smo, KAAD-циклопамин, как было показано, замедляет рост опухолей и уменьшает размер опухоли (8, 9).
После активации Smo способствует ядерной транслокации семейства транскрипционных факторов Ci в Drosophila и Glis (Gli1, Gli2 и Gli3) у позвоночных в активные гены-мишени Hh (3, 5). Различные виды рака у человека вызываются мутациями, которые приводят к несоответствующей активации пути Hh.Например, мутации избыточной активации в гене Smo и мутации потери функции в гене ptch вызывают большинство случаев рака человека и мыши (6, 7), а также ингибирование этого пути с помощью антител, блокирующих лиганд. или ингибитор Smo, KAAD-циклопамин, как было показано, замедляет рост опухолей и уменьшает размер опухоли (8, 9).
Недавно сообщалось, что путь передачи сигналов Hh участвует не только в васкуляризации de novo определенных эмбриональных тканей, но также и в индукции ангиогенеза в системе взрослых млекопитающих (10).Кроме того, наблюдения др. Групп показали, что передача сигналов Hh играет роль в контроле подвижности и миграции множественных типов клеток (11-13). Кроме того, исследования, проведенные Hochman et al. (14) предположили, что компоненты сигнального пути Shh напрямую участвуют в процессах миграции клеток и ангиогенеза, тогда как ингибирование этого пути блокирует Shh-индуцированную миграцию клеток и ангиогенез. Взятые вместе, эти наблюдения подразумевают, что активность Hh коррелирует с серьезностью ассоциированной опухоли и что эта активность необходима и достаточна для поддержания метастатического поведения.
Кроме того, исследования, проведенные Hochman et al. (14) предположили, что компоненты сигнального пути Shh напрямую участвуют в процессах миграции клеток и ангиогенеза, тогда как ингибирование этого пути блокирует Shh-индуцированную миграцию клеток и ангиогенез. Взятые вместе, эти наблюдения подразумевают, что активность Hh коррелирует с серьезностью ассоциированной опухоли и что эта активность необходима и достаточна для поддержания метастатического поведения.
Трансформирующий фактор роста (TGF) -β представляет собой плейотропный цитокин, который играет решающую роль в модуляции роста, дифференцировки, пластичности и миграции клеток. TGF-β в первую очередь передает сигналы путем связывания с отдельными рецепторами с присущей серин / треонинкиназной активностью, рецептором TGF-β типа I и рецептором TGF-β типа II (TβRII). Связывание TGF-β с TβRII приводит к рекрутированию и трансфосфорилированию TGF-β рецептора I типа [также называемого активин-рецептор-подобной киназой (ALK)] и к активации активируемых рецептором Smads (15-17). Передача сигналов TGF-β опосредуется либо ALK1, либо ALK5 (18), что происходит посредством фосфорилирования Smad 1, 5 и 8 или Smad 2 и 3 соответственно. Рецепторы TGF-β, которые действуют как опухолевые супрессоры в нормальных и предопухолевых тканях, приобретают онкогенные функции во время опухолевой прогрессии. Кроме того, рецепторы TGF-β мутируют или экспрессируются на существенно ослабленных уровнях при различных раковых заболеваниях человека и коррелируют с приобретением устойчивости к подавлению роста с помощью TGF-β (19–21).Кроме того, сообщалось, что экспрессия конститутивно активных мутантов ALK5 усиливает инвазию опухоли и ангиогенез в некоторых клетках, регулируя экспрессию матриксных металлопротеиназ (ММП) (22, 23). Кроме того, активация митоген-активируемых протеинкиназ и сигнальных каскадов PI3K / Akt рецепторами TGF-β также может потенциально способствовать миграции и инвазии клеток (24–26).
Передача сигналов TGF-β опосредуется либо ALK1, либо ALK5 (18), что происходит посредством фосфорилирования Smad 1, 5 и 8 или Smad 2 и 3 соответственно. Рецепторы TGF-β, которые действуют как опухолевые супрессоры в нормальных и предопухолевых тканях, приобретают онкогенные функции во время опухолевой прогрессии. Кроме того, рецепторы TGF-β мутируют или экспрессируются на существенно ослабленных уровнях при различных раковых заболеваниях человека и коррелируют с приобретением устойчивости к подавлению роста с помощью TGF-β (19–21).Кроме того, сообщалось, что экспрессия конститутивно активных мутантов ALK5 усиливает инвазию опухоли и ангиогенез в некоторых клетках, регулируя экспрессию матриксных металлопротеиназ (ММП) (22, 23). Кроме того, активация митоген-активируемых протеинкиназ и сигнальных каскадов PI3K / Akt рецепторами TGF-β также может потенциально способствовать миграции и инвазии клеток (24–26).
Несмотря на критическую роль, которую передача сигналов Hh играет в стимулировании туморогенеза, молекулярные и клеточные механизмы, лежащие в основе регуляции Hh при метастатическом поведении опухоли, неизвестны. Здесь мы сообщаем, что сигнальный путь Shh, действующий через путь TGF-β-ALK5, может избирательно вносить вклад в подвижность опухолевых клеток и инвазию при раке желудка. Кроме того, мы показываем, что нарушение передачи сигналов TGF-β-ALK5 нейтрализующим антителом против TGF-β или ингибитором киназы ALK5 приводит к подавлению Shh-опосредованной миграции и инвазии клеток. Основываясь на этих находках, мы предполагаем, что путь передачи сигналов Shh индуцирует метастатические функции рака желудка посредством рекрутирования передачи сигналов TGF-β – ALK5 – Smad 3.
Здесь мы сообщаем, что сигнальный путь Shh, действующий через путь TGF-β-ALK5, может избирательно вносить вклад в подвижность опухолевых клеток и инвазию при раке желудка. Кроме того, мы показываем, что нарушение передачи сигналов TGF-β-ALK5 нейтрализующим антителом против TGF-β или ингибитором киназы ALK5 приводит к подавлению Shh-опосредованной миграции и инвазии клеток. Основываясь на этих находках, мы предполагаем, что путь передачи сигналов Shh индуцирует метастатические функции рака желудка посредством рекрутирования передачи сигналов TGF-β – ALK5 – Smad 3.
Материалы и методы
Клетки и ткани
Клеточные линии карциномы желудка человека, AGS и MKN-28, были получены из Американской коллекции типовых культур (Манассас, Вирджиния) и содержались в соответствии с инструкциями Американской коллекции типовых культур. Ткань рака желудка человека, полученная из банка тканей больницы Гуро Корейского университета. Для этого исследования был выбран 41 пациент с раком желудка. В это исследование были включены тридцать два образца метастазов в лимфатические узлы и девять образцов рака желудка с отрицательными лимфатическими узлами.Этот протокол был рассмотрен и разрешен институциональным наблюдательным советом больницы Гуро.
Для этого исследования был выбран 41 пациент с раком желудка. В это исследование были включены тридцать два образца метастазов в лимфатические узлы и девять образцов рака желудка с отрицательными лимфатическими узлами.Этот протокол был рассмотрен и разрешен институциональным наблюдательным советом больницы Гуро.
Реактивы и антитела
Антитело против N-концевого пептида Shh, рекомбинантный человеческий N-Shh, рекомбинантный человеческий TGF-β1 и моноклональное анти-TGF-β антитело, которое полностью нейтрализует активность изомерных форм TGF-β1, TGF-β2 и TGF-β3 , были приобретены у R&D Systems (Миннеаполис, Миннесота). КААД-циклопамин был приобретен у Calbiochem (Сан-Диего, Калифорния) и разбавлен диметилсульфоксидом (контрольный носитель).SB 431542 был приобретен у TOCRIS Bioscience (Эллисвилл, Миссури). Кроличьи анти-ALK5, кроличьи анти-фосфо-Smad 3 (Ser433 / 435) и кроличьи анти-Smad 3 были получены от Cell Signaling Technology (Беверли, Массачусетс). Кроличьи антитела против ALK1 и мышиные антитела против β-актина были получены от Sigma. Кроличий рецептор против TGF-β был приобретен в Santa Cruz Biotechnology (Санта-Крус, Калифорния).
Кроличьи антитела против ALK1 и мышиные антитела против β-актина были получены от Sigma. Кроличий рецептор против TGF-β был приобретен в Santa Cruz Biotechnology (Санта-Крус, Калифорния).
Анализ пролиферации клеток
Клетки высевали в концентрации 4 × 10 3 клеток на 100 мкл культуральной среды на лунку в 96-луночные планшеты.К некоторым клеткам добавляли N-Shh, и через 24 или 48 ч количество жизнеспособных клеток определяли в трех повторностях лунок с использованием анализа 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида ( Roche) согласно инструкции производителя.
Анализ заживления ран
клеток AGS и MKN-28 высевали из расчета 1 × 10 5 клеток / лунку в 12-луночные планшеты, а затем предварительно инкубировали в течение 24 часов в бессывороточной RPMI (Invitrogen) перед нанесением ран через клеточный монослой пластиковым наконечником.Затем клетки выращивали в необработанной культуральной среде или обрабатывали различными лекарственными средствами в присутствии или в отсутствие N-Shh. Затем миграцию клеток в поверхность раны контролировали с помощью микроскопии через 24 часа и сообщали как расчетное отношение оставшейся площади раны к исходной площади раны. Количественное определение закрытия монослоя было выполнено с использованием программы NIH Image, и результаты выражены в виде процента закрытия раны. Этот анализ был повторен три раза независимо.
Затем миграцию клеток в поверхность раны контролировали с помощью микроскопии через 24 часа и сообщали как расчетное отношение оставшейся площади раны к исходной площади раны. Количественное определение закрытия монослоя было выполнено с использованием программы NIH Image, и результаты выражены в виде процента закрытия раны. Этот анализ был повторен три раза независимо.
Анализ инвазии матригеля
Всего 1 × 10 5 клеток / лунку засевали в верхнюю камеру, которая была покрыта матригелем (Calbiochem), и бессывороточную среду, содержащую различные концентрации N-Shh, добавляли в нижнюю камеру. Через 24 ч инкубации немигрирующие клетки удаляли из верхней камеры с помощью ватного тампона, а клетки, присутствующие на нижней поверхности вставки, окрашивали красителем Diff-Quik (Biochemical Sciences, Swedesboro, NJ).Затем инвазивные клетки подсчитывали под микроскопом. Все эксперименты повторяли трижды.
Трансфекция малой интерферирующей РНК
Дуплекс малых интерферирующих РНК (миРНК), специфичных к TGF-β1, ALK5 или Smad 3, был синтезирован в Invitrogen. Используемые последовательности миРНК были следующими: миРНК TGF-β1, 5′-GGG CUA CCA UGC CAA CUU CTT-3 ‘и 5′-GAA GUU GGC AUG GUA GCC CTT-3′, ALK5 siRNA, 5’-CAU AUU GCU GCA ACC AGG ATT-3 ‘и 5′-UCC UGG UUG CAG CAA UAU GTT-3′ и Smad 3 siRNA, 5’-GAU CUU CAA CAA CCA GGA GTT-3 ‘и 5’-CUC CUG GUU GUU GAA GAU GAU СТТ-3 ′.В качестве неспецифической контрольной миРНК использовали дуплекс скремблированной миРНК. Трансфекцию проводили с использованием реагента Lipofectamine 2000 (Invitrogen) в соответствии с инструкциями производителя.
Используемые последовательности миРНК были следующими: миРНК TGF-β1, 5′-GGG CUA CCA UGC CAA CUU CTT-3 ‘и 5′-GAA GUU GGC AUG GUA GCC CTT-3′, ALK5 siRNA, 5’-CAU AUU GCU GCA ACC AGG ATT-3 ‘и 5′-UCC UGG UUG CAG CAA UAU GTT-3′ и Smad 3 siRNA, 5’-GAU CUU CAA CAA CCA GGA GTT-3 ‘и 5’-CUC CUG GUU GUU GAA GAU GAU СТТ-3 ′.В качестве неспецифической контрольной миРНК использовали дуплекс скремблированной миРНК. Трансфекцию проводили с использованием реагента Lipofectamine 2000 (Invitrogen) в соответствии с инструкциями производителя.
Количественное определение TGF-β1
Клетки
высевали с плотностью 5 × 10 4 клеток в шестилуночные планшеты, культивировали в бессывороточных условиях, а затем не обрабатывали или обрабатывали различными лекарствами в присутствии или в отсутствие N-Shh в течение 24 часов. Для приготовления кондиционированной среды использовали бессывороточные условия, чтобы избежать переноса латентного TGF-β1 в сыворотку.После воздействия различных лекарств с N-Shh или без него количество TGF-β1, высвобожденного в супернатанты клеточных культур, измеряли с использованием наборов для иммуноанализа Quantikine human TGF-β1 (R&D Systems, Milwaukee, WI). Вкратце, активированные кислотой образцы и стандарты в трех экземплярах добавляли в предварительно покрытые микропланшеты и инкубировали при комнатной температуре в течение 2 часов. Затем добавляли второе антитело, поликлональное антитело против TGF-β1, чтобы завершить сэндвич, а затем конъюгат TGF-β1 с пероксидазой хрена. TGF-β1 определяли путем добавления хромогенного субстрата с последующим введением стоп-раствора.Поглощение определяли при оптической плотности 450 нм.
Вкратце, активированные кислотой образцы и стандарты в трех экземплярах добавляли в предварительно покрытые микропланшеты и инкубировали при комнатной температуре в течение 2 часов. Затем добавляли второе антитело, поликлональное антитело против TGF-β1, чтобы завершить сэндвич, а затем конъюгат TGF-β1 с пероксидазой хрена. TGF-β1 определяли путем добавления хромогенного субстрата с последующим введением стоп-раствора.Поглощение определяли при оптической плотности 450 нм.
Люциферазный анализ
Клетки высевали с плотностью 3 × 10 4 клеток / лунку в шестилуночные планшеты и затем трансфицировали 3TP-Lux (1 мкг) или CMV-renilla (1 мкг) с использованием липофектамина 2000. Через шесть часов после трансфекции среду заменяли новой средой, обработанной либо N-Shh, либо ингибиторами, как указано в подписях к рисункам, в течение 24 часов перед сбором урожая. Затем активность люциферазы измеряли с использованием наборов для анализа люциферазы (Promega) и нормализовали до активности люциферазы Renilla .
Вестерн-блоттинг
Экстракцию целых клеток проводили с использованием буфера RIPA [50 мМ Трис, 150 мМ NaCl, 1% Тритон X-100, 0,1% додецилсульфата натрия и 1% дезоксихолата натрия (pH 7,4)] с добавлением ингибиторов протеаз (1 мМ фенилметилсульфонилфторид , 10 мкг / мл пептазина А, 10 мкг / мл апротинина и 5 мкг / мл лейпептина). Затем измеряли концентрации белка, используя наборы для анализа белков Bio-Rad (Bio-Rad, Hercules, CA). Затем лизаты белков разделяли электрофорезом в додецилсульфат-полиакриламидном геле натрия, затем переносили на нитроцеллюлозные мембраны (Hybond ™ -P; Amersham Biosciences, Piscataway, NJ), блокировали фосфатно-солевым буфером (PBS), содержащим 0.2% твин 20 и 5% обезжиренное сухое молоко, инкубированное с первичным антителом, а затем с вторичным антителом, меченным пероксидазой хрена. Затем сигналы регистрировались с помощью рентгеновской пленки.
Желатиновая зимография
Активность ММП-2 и -9 в кондиционированной среде определяли с помощью желатиновой зимографии. Вкратце, кондиционированные среды собирали и центрифугировали. Затем образцы наносили на гели додецилсульфат-полиакриламид натрия, которые полимеризовали с желатином до конечной концентрации 1 мг / мл.После электрофореза гели ренатурировали в 2,5% Triton X-100 и затем инкубировали в проявляющем буфере [50 мМ трис-HCl-буфер (pH 7,4) в присутствии 5 мМ CaCl 2 в течение ночи при 37 ° C. Затем гели окрашивали 0,5% кумасси синим R-250 и обесцвечивали в 10% метаноле и 5% уксусной кислоте в воде. Затем активность желатиназы визуализировали в виде прозрачных полос на синем фоне, а размеры молекул определяли на основе подвижности с использованием стандартов зимографии желатина (Chemicon).Было проведено три индивидуальных эксперимента с использованием независимо полученных образцов белка.
Вкратце, кондиционированные среды собирали и центрифугировали. Затем образцы наносили на гели додецилсульфат-полиакриламид натрия, которые полимеризовали с желатином до конечной концентрации 1 мг / мл.После электрофореза гели ренатурировали в 2,5% Triton X-100 и затем инкубировали в проявляющем буфере [50 мМ трис-HCl-буфер (pH 7,4) в присутствии 5 мМ CaCl 2 в течение ночи при 37 ° C. Затем гели окрашивали 0,5% кумасси синим R-250 и обесцвечивали в 10% метаноле и 5% уксусной кислоте в воде. Затем активность желатиназы визуализировали в виде прозрачных полос на синем фоне, а размеры молекул определяли на основе подвижности с использованием стандартов зимографии желатина (Chemicon).Было проведено три индивидуальных эксперимента с использованием независимо полученных образцов белка.
Иммуногистохимия
Срезы (толщиной 5 м) фиксированных формалином и залитых парафином образцов опухоли депарафинизировали в ксилоле и регидратировали в спирте с определенным содержанием. Извлечение антигена проводили с помощью облучения в микроволновой печи в течение 20 минут в сосуде, содержащем 0,01 М цитратный буфер (pH 6,0), и помещали в 0,025% трипсин и 50 мМ Трис-буфер на 5 минут. Эндогенную пероксидазу блокировали с помощью 3% перекиси водорода в PBS в течение 12 мин.Образцы инкубировали с раствором, блокирующим белок, состоящим из PBS (pH 7,5), содержащего 5% нормальной ослиной сыворотки, в течение 30 минут при комнатной температуре, а затем инкубировали при 4 ° C в течение ночи в разведении 1:50 кроличьих поликлональных антител против человека. Gli (Cell Signaling Technology, Дэнверс, Массачусетс). В случае окрашивания ALK5 предметное стекло инкубировали с разведением 1: 100 кроличьего поликлонального антитела против человеческого ALK5 (Santa Cruz Biotechnology). Затем образцы промывали и инкубировали с конъюгированным с пероксидазой антителом против кроличьего IgG в течение 1 часа при комнатной температуре.Затем предметные стекла промывали PBS и инкубировали в течение 5 мин с диаминобензидином (Research Genetics, Huntsville, AL).
Извлечение антигена проводили с помощью облучения в микроволновой печи в течение 20 минут в сосуде, содержащем 0,01 М цитратный буфер (pH 6,0), и помещали в 0,025% трипсин и 50 мМ Трис-буфер на 5 минут. Эндогенную пероксидазу блокировали с помощью 3% перекиси водорода в PBS в течение 12 мин.Образцы инкубировали с раствором, блокирующим белок, состоящим из PBS (pH 7,5), содержащего 5% нормальной ослиной сыворотки, в течение 30 минут при комнатной температуре, а затем инкубировали при 4 ° C в течение ночи в разведении 1:50 кроличьих поликлональных антител против человека. Gli (Cell Signaling Technology, Дэнверс, Массачусетс). В случае окрашивания ALK5 предметное стекло инкубировали с разведением 1: 100 кроличьего поликлонального антитела против человеческого ALK5 (Santa Cruz Biotechnology). Затем образцы промывали и инкубировали с конъюгированным с пероксидазой антителом против кроличьего IgG в течение 1 часа при комнатной температуре.Затем предметные стекла промывали PBS и инкубировали в течение 5 мин с диаминобензидином (Research Genetics, Huntsville, AL). Срезы промывали трижды дистиллированной водой, контрастировали гематоксилином Майера (Biogenx Laboratories, Сан-Рамон, Калифорния) и промывали по одному разу дистиллированной водой и PBS. После этого слайды были закреплены на универсальном держателе (Research Genetics) и исследованы с помощью светлопольного микроскопа. В зависимости от процента положительных клеток и интенсивности окрашивания окрашивание Gli и ALK5 было разделено на три группы: отрицательная, слабая и сильная экспрессия.В частности, процент положительных клеток был разделен на пять баллов (процентные баллы): 0 (<10%), 1 (10–25%), 2 (26–50%), 3 (51–75%) и 4 ( > 75%). Интенсивность окрашивания была разделена на четыре степени (баллы интенсивности): 0 (отсутствие окрашивания), 1 (светло-коричневый), 2 (коричневый) и 3 (темно-коричневый). Положительное окрашивание определяли по следующей формуле: общая оценка = процентная оценка × оценка интенсивности. Общий балл от ≤3, от> 3 до ≤6, от> 6 до ≤9 и> 9 был определен как отрицательное, слабое, умеренное и сильное выражение соответственно.
Срезы промывали трижды дистиллированной водой, контрастировали гематоксилином Майера (Biogenx Laboratories, Сан-Рамон, Калифорния) и промывали по одному разу дистиллированной водой и PBS. После этого слайды были закреплены на универсальном держателе (Research Genetics) и исследованы с помощью светлопольного микроскопа. В зависимости от процента положительных клеток и интенсивности окрашивания окрашивание Gli и ALK5 было разделено на три группы: отрицательная, слабая и сильная экспрессия.В частности, процент положительных клеток был разделен на пять баллов (процентные баллы): 0 (<10%), 1 (10–25%), 2 (26–50%), 3 (51–75%) и 4 ( > 75%). Интенсивность окрашивания была разделена на четыре степени (баллы интенсивности): 0 (отсутствие окрашивания), 1 (светло-коричневый), 2 (коричневый) и 3 (темно-коричневый). Положительное окрашивание определяли по следующей формуле: общая оценка = процентная оценка × оценка интенсивности. Общий балл от ≤3, от> 3 до ≤6, от> 6 до ≤9 и> 9 был определен как отрицательное, слабое, умеренное и сильное выражение соответственно.
Статистический анализ
Двусторонний тест × 2 был проведен для определения значимости разницы между ковариатами. P Значения менее 0,05 были определены как статистически значимые. Для анализа использовалась программа SPSS (версия 13.0, SPSS, Чикаго, Иллинойс).
Результаты
Передача сигналов Shh стимулирует миграцию и инвазию клеток рака желудка
Чтобы исследовать роль передачи сигналов Shh, поскольку она связана с инвазивными фенотипами и подвижностью клеток рака желудка, мы протестировали эффекты передачи сигналов Shh на подвижность клеток AGS и MKN-28 в анализе закрытия ран.Перед оценкой подвижности мы убедились, что гены-мишени Hh, Shh , PTCH , Smo и Gli , были экспрессированы в клетках AGS и MKN-28 в соответствии с данными предыдущих исследований (данные не показано) (27). Затем эти клетки обрабатывали возрастающими концентрациями N-Shh и оценивали их способность закрывать рану с течением времени. Значительное увеличение процента общей площади, покрытой клетками, которые были подвергнуты обработке N-Shh, было очевидным через 12 часов после образования раны, а среднее увеличение подвижности обработанных N-Shh клеток (0.5 мкг / мл) было в 2,5 раза больше ( P <0,001), чем у необработанных контрольных клеток через 24 часа. Кроме того, наши результаты также показали, что N-Shh вызывает дозозависимую регуляцию миграции. У клеток, обработанных N-Shh в дозах 0,1–0,5 мкг / мл в течение 24 ч, наблюдалось значительное увеличение подвижности клеток, независимо от того, был ли ответ на более высокие дозы N-Shh (0,5–1 мкг / мл) незначительным. Взятые вместе, эти результаты показывают, что максимальный эффект N-Shh на миграцию имел место в клетках, обработанных концентрацией 0.5 мкг / мл в течение 24 часов (рис. 1A и B). На общий рост клеток не влияла обработка N-Shh, когда клетки обрабатывались той же концентрацией и в течение того же периода времени, что указывает на то, что различие в подвижности не было связано с влиянием на пролиферацию (рис.
Затем эти клетки обрабатывали возрастающими концентрациями N-Shh и оценивали их способность закрывать рану с течением времени. Значительное увеличение процента общей площади, покрытой клетками, которые были подвергнуты обработке N-Shh, было очевидным через 12 часов после образования раны, а среднее увеличение подвижности обработанных N-Shh клеток (0.5 мкг / мл) было в 2,5 раза больше ( P <0,001), чем у необработанных контрольных клеток через 24 часа. Кроме того, наши результаты также показали, что N-Shh вызывает дозозависимую регуляцию миграции. У клеток, обработанных N-Shh в дозах 0,1–0,5 мкг / мл в течение 24 ч, наблюдалось значительное увеличение подвижности клеток, независимо от того, был ли ответ на более высокие дозы N-Shh (0,5–1 мкг / мл) незначительным. Взятые вместе, эти результаты показывают, что максимальный эффект N-Shh на миграцию имел место в клетках, обработанных концентрацией 0.5 мкг / мл в течение 24 часов (рис. 1A и B). На общий рост клеток не влияла обработка N-Shh, когда клетки обрабатывались той же концентрацией и в течение того же периода времени, что указывает на то, что различие в подвижности не было связано с влиянием на пролиферацию (рис. 1C). Чтобы подтвердить вклад передачи сигналов Shh в подвижность клеток рака желудка, клетки обрабатывали селективными ингибиторами пути передачи сигналов Shh. Дополнительная инкубация клеток, обработанных N-Shh, с контрольным носителем или KAAD-циклопамином, специфическим ингибитором Smo, обращала стимулирующий эффект N-Shh на миграцию клеток на 71% и 63%.1% ингибирование, соответственно, в AGS и MKN-28 по сравнению с клетками, обработанными N-Shh плюс контрольный носитель (рис. 1D и E). Сходные результаты были получены, когда клетки обрабатывали блокирующим антителом против Shh, при этом ингибирование на 70% и 68,7%, соответственно, наблюдалось в AGS и MKN-28, по сравнению с клетками, обработанными антителом N-Shh плюс IgG (рис. 1D и E ). Взятые вместе, эти результаты демонстрируют, что передача сигналов Shh играет важную роль в подвижности клеток рака желудка.
1C). Чтобы подтвердить вклад передачи сигналов Shh в подвижность клеток рака желудка, клетки обрабатывали селективными ингибиторами пути передачи сигналов Shh. Дополнительная инкубация клеток, обработанных N-Shh, с контрольным носителем или KAAD-циклопамином, специфическим ингибитором Smo, обращала стимулирующий эффект N-Shh на миграцию клеток на 71% и 63%.1% ингибирование, соответственно, в AGS и MKN-28 по сравнению с клетками, обработанными N-Shh плюс контрольный носитель (рис. 1D и E). Сходные результаты были получены, когда клетки обрабатывали блокирующим антителом против Shh, при этом ингибирование на 70% и 68,7%, соответственно, наблюдалось в AGS и MKN-28, по сравнению с клетками, обработанными антителом N-Shh плюс IgG (рис. 1D и E ). Взятые вместе, эти результаты демонстрируют, что передача сигналов Shh играет важную роль в подвижности клеток рака желудка.
Рис.1.
Передача сигналов Shh способствует миграции клеток рака желудка. ( A ) Конфлюентные монослои клеток AGS и MKN-28 ранили кончиком пипетки, а затем обрабатывали с увеличивающимися концентрациями N-Shh или без них. Затем миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( B ) Процент общей площади, покрытой клетками, оценивали с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах.** P <0,001 по сравнению с необработанными контрольными группами. ( C ) Пролиферацию клеток AGS и MKN-28, обработанных указанными концентрациями N-Shh, определяли с использованием анализов жизнеспособности 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. ( D ) Конфлюэнтные монослои AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с возрастающей концентрацией KAAD-циклопамина (циклопамина), контрольного носителя (диметил сульфоксид), антитела, блокирующие Shh, или контрольные антитела IgG в бессывороточной среде.
Затем миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( B ) Процент общей площади, покрытой клетками, оценивали с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах.** P <0,001 по сравнению с необработанными контрольными группами. ( C ) Пролиферацию клеток AGS и MKN-28, обработанных указанными концентрациями N-Shh, определяли с использованием анализов жизнеспособности 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. ( D ) Конфлюэнтные монослои AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с возрастающей концентрацией KAAD-циклопамина (циклопамина), контрольного носителя (диметил сульфоксид), антитела, блокирующие Shh, или контрольные антитела IgG в бессывороточной среде. Миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( E ) Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( E ) Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Рис. 1.
Передача сигналов Shh способствует миграции клеток рака желудка.( A ) Конфлюентные монослои клеток AGS и MKN-28 ранили кончиком пипетки, а затем обрабатывали с увеличивающимися концентрациями N-Shh или без них. Затем миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( B ) Процент общей площади, покрытой клетками, оценивали с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. ** P <0,001 по сравнению с необработанными контрольными группами.( C ) Пролиферацию клеток AGS и MKN-28, обработанных указанными концентрациями N-Shh, определяли с использованием анализов жизнеспособности 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. ( D ) Конфлюэнтные монослои AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с возрастающей концентрацией KAAD-циклопамина (циклопамина), контрольного носителя (диметил сульфоксид), антитела, блокирующие Shh, или контрольные антитела IgG в бессывороточной среде.Миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( E ) Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах.
** P <0,001 по сравнению с необработанными контрольными группами.( C ) Пролиферацию клеток AGS и MKN-28, обработанных указанными концентрациями N-Shh, определяли с использованием анализов жизнеспособности 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. ( D ) Конфлюэнтные монослои AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с возрастающей концентрацией KAAD-циклопамина (циклопамина), контрольного носителя (диметил сульфоксид), антитела, блокирующие Shh, или контрольные антитела IgG в бессывороточной среде.Миграцию клеток в область раны контролировали под микроскопом в течение 24 ч после раны. ( E ) Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
* P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Затем влияние передачи сигналов Shh на инвазию клеток рака желудка было измерено с использованием анализа инвазии Matrigel.Способность клеток рака желудка проникать в матригель была заметно усилена обработкой увеличивающимися концентрациями N-Shh, как показано в анализе закрытия ран (рис. 2А). Напротив, индуцированная N-Shh инвазивность клеток AGS и MKN-28 была снижена почти на 97% и 91% соответственно в клетках, обработанных KAAD-циклопамином, а инвазивность снизилась на 87% и 81%, соответственно, в клетках, обработанных анти-Shh блокирующим антителом, по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно (рис. 2B и C), демонстрируя, что передача сигналов Shh играет важную роль в инвазивности. клеток рака желудка.
Рис. 2.
Передача сигналов Shh способствует инвазии клеток рака желудка. ( A ) Клетки AGS (1 × 10 5 клеток / лунку) высевали в верхнюю камеру, которая была покрыта матригелем, и бессывороточную среду, содержащую различные концентрации N-Shh, добавляли в нижнюю камеру. Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение.** P <0,001 по сравнению с необработанными контрольными группами. Среда для выращивания, обработанная только N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид) ( B ), блокирующих анти-Shh или контрольных антител IgG ( C ), была добавляли в нижнюю камеру, а клетки AGS и MKN-28 засевали в верхнюю камеру. Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом.
( A ) Клетки AGS (1 × 10 5 клеток / лунку) высевали в верхнюю камеру, которая была покрыта матригелем, и бессывороточную среду, содержащую различные концентрации N-Shh, добавляли в нижнюю камеру. Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение.** P <0,001 по сравнению с необработанными контрольными группами. Среда для выращивания, обработанная только N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид) ( B ), блокирующих анти-Shh или контрольных антител IgG ( C ), была добавляли в нижнюю камеру, а клетки AGS и MKN-28 засевали в верхнюю камеру. Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Рис. 2.
Передача сигналов Shh способствует инвазии клеток рака желудка. ( A ) Клетки AGS (1 × 10 5 клеток / лунку) высевали в верхнюю камеру, которая была покрыта матригелем, и бессывороточную среду, содержащую различные концентрации N-Shh, добавляли в нижнюю камеру.Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. ** P <0,001 по сравнению с необработанными контрольными группами. Среда для выращивания, обработанная только N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид) ( B ), блокирующих анти-Shh или контрольных антител IgG ( C ), была добавляли в нижнюю камеру, а клетки AGS и MKN-28 засевали в верхнюю камеру. Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Через 24 часа инкубации клетки, которые проникли на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Передача сигналов TGF-β опосредует Shh-индуцированную миграцию и инвазию клеток рака желудка
Многочисленные исследования показали, что более агрессивные формы опухолей стимулируются TGF-β (28, 29).Wang et al. (30) сообщил, что TGF-β может модулировать метастатический потенциал клеток рака желудка, разрушая барьеры базальной мембраны и способствуя их подвижности. Вышеуказанные результаты также демонстрируют, что сигнальный путь Shh играет решающую роль в подвижности и инвазивности клеток рака желудка, что указывает на то, что активация сигнального пути TGF-β может влиять на опосредованную Shh клеточную подвижность и инвазию (рисунки 1 и 2). . Чтобы изучить эту возможность, мы затем протестировали роль передачи сигналов TGF-β в Shh-обеспечиваемых миграционных свойствах.Клетки AGS и MKN-28 обрабатывали возрастающими концентрациями N-Shh с TGF-β1 или без него (5 нг / мл), а затем оценивали их подвижность и инвазивную способность. Наши результаты показали, что TGF-β1 в отсутствие Shh немного стимулировал миграцию и инвазивность этих клеток, тогда как комбинация возрастающих концентраций N-Shh и TGF-β1 (5 нг / мл) значительно стимулировала миграцию и инвазивность. этих ячеек (рис. 3A и D). Чтобы определить, может ли отмена передачи сигналов TGF-β блокировать Shh-опосредованную клеточную подвижность и инвазию, мы заблокировали передачу сигналов TGF-β с помощью блокирующих антител против TGF-β или миРНК TGF-β1.Как показано на Фигуре 3, стимулирующие эффекты N-Shh на миграцию и инвазию клеток были полностью устранены обработкой антителом, блокирующим TGF-β (Фигуры 3B и E), и обработкой миРНК TGF-β1 (Фигуры 3C и F), но не контрольным антителом IgG или неспецифической миРНК.
. Чтобы изучить эту возможность, мы затем протестировали роль передачи сигналов TGF-β в Shh-обеспечиваемых миграционных свойствах.Клетки AGS и MKN-28 обрабатывали возрастающими концентрациями N-Shh с TGF-β1 или без него (5 нг / мл), а затем оценивали их подвижность и инвазивную способность. Наши результаты показали, что TGF-β1 в отсутствие Shh немного стимулировал миграцию и инвазивность этих клеток, тогда как комбинация возрастающих концентраций N-Shh и TGF-β1 (5 нг / мл) значительно стимулировала миграцию и инвазивность. этих ячеек (рис. 3A и D). Чтобы определить, может ли отмена передачи сигналов TGF-β блокировать Shh-опосредованную клеточную подвижность и инвазию, мы заблокировали передачу сигналов TGF-β с помощью блокирующих антител против TGF-β или миРНК TGF-β1.Как показано на Фигуре 3, стимулирующие эффекты N-Shh на миграцию и инвазию клеток были полностью устранены обработкой антителом, блокирующим TGF-β (Фигуры 3B и E), и обработкой миРНК TGF-β1 (Фигуры 3C и F), но не контрольным антителом IgG или неспецифической миРНК. Взятые вместе, эти находки показывают, что передача сигналов Shh модулирует миграцию и инвазию клеток рака желудка посредством активации сигналов TGF-β.
Взятые вместе, эти находки показывают, что передача сигналов Shh модулирует миграцию и инвазию клеток рака желудка посредством активации сигналов TGF-β.
Рис. 3.
Передача сигналов TGF-β опосредует Shh-индуцированную клеточную миграцию и инвазию.( A ) Конфлюэнтные монослои клеток AGS и MKN-28 были ранены кончиком пипетки, а затем обработаны увеличивающимися концентрациями N-Shh с или без TGF-β (5 нг / мл), и затем миграция клеток в область раны была наблюдали в течение 24 часов после ранения. Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01, ** P <0.001 по сравнению с группами 5 нг / мл TGF-β. Конфлюэнтные клетки AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с увеличивающимся блокирующим антителом против TGF-β, контрольным антителом IgG ( B ), TGF -β миРНК (100 нМ) или неспецифическая миРНК ( C ) в бессывороточной среде. Затем наблюдали за миграцией клеток в область раны в течение 24 часов после раны и затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image.Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001, по сравнению с контрольными группами (антитело IgG к блокирующим антителам против TGF-β и неспецифическая миРНК для миРНК TGF-β, соответственно). ( D ) Затем в нижнюю камеру добавляли питательную среду, обработанную возрастающими концентрациями N-Shh в присутствии или в отсутствие TGF-β (5 нг / мл), и клетки AGS и MKN-28 высевали в верхнюю камеру. камера.Через 24 часа инкубации клетки, которые мигрировали на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. ** P <0,001 по сравнению с группами 5 нг / мл TGF-β. Клетки AGS и MKN-28, обработанные только N-Shh (0,5 мкг / мл) или вместе с увеличивающимся блокирующим антителом против TGF-β, контрольным антителом IgG ( E ), TGF-β siRNA (100 нМ) или без -специфические миРНК ( F ) затем оценивали с помощью анализа на инвазию.Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001, по сравнению с контрольными группами (антитело IgG к блокирующим антителам против TGF-β и неспецифическая миРНК для миРНК TGF-β, соответственно).
Рис. 3.
Передача сигналов TGF-β опосредует Shh-индуцированную клеточную миграцию и инвазию. ( A ) Конфлюэнтные монослои клеток AGS и MKN-28 были ранены кончиком пипетки, а затем обработаны увеличивающимися концентрациями N-Shh с или без TGF-β (5 нг / мл), и затем миграция клеток в область раны была наблюдали в течение 24 часов после ранения.Затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01, ** P <0,001, по сравнению с группами 5 нг / мл TGF-β. Конфлюэнтные клетки AGS и MKN-28 были ранены кончиком пипетки и затем обработаны только N-Shh (0,5 мкг / мл) или вместе с увеличивающимся блокирующим антителом против TGF-β, контрольным антителом IgG ( B ), TGF -β миРНК (100 нМ) или неспецифическая миРНК ( C ) в бессывороточной среде.Затем наблюдали за миграцией клеток в область раны в течение 24 часов после раны и затем оценивали процент общей площади, покрытой клетками, с помощью программы NIH Image. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001, по сравнению с контрольными группами (антитело IgG к блокирующим антителам против TGF-β и неспецифическая миРНК для миРНК TGF-β, соответственно). ( D ) Затем в нижнюю камеру добавляли питательную среду, обработанную возрастающими концентрациями N-Shh в присутствии или в отсутствие TGF-β (5 нг / мл), и клетки AGS и MKN-28 высевали в верхнюю камеру. камера.Через 24 часа инкубации клетки, которые мигрировали на нижнюю поверхность вставки, окрашивали Diff-Quik Stain и подсчитывали под микроскопом. Для каждой точки данных подсчитывали пять различных областей пораженных клеток ( n = 5). Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. ** P <0,001 по сравнению с группами 5 нг / мл TGF-β. Клетки AGS и MKN-28, обработанные только N-Shh (0,5 мкг / мл) или вместе с увеличивающимся блокирующим антителом против TGF-β, контрольным антителом IgG ( E ), TGF-β siRNA (100 нМ) или без -специфические миРНК ( F ) затем оценивали с помощью анализа на инвазию.Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001, по сравнению с контрольными группами (антитело IgG к блокирующим антителам против TGF-β и неспецифическая миРНК для миРНК TGF-β, соответственно).
Сигнальный путь Shh индуцирует секрецию TGF-β и активирует транскрипционный ответ TGF-β в клетках рака желудка
Затем, чтобы определить, является ли N-Shh-стимулированная миграция и инвазия клеток результатом повышенных уровней белка TGF-β, мы исследовали секрецию белка TGF-β1, используя специфические иммуноферментные анализы для количественного определения количества TGF-β1 в среда, в которой культивировали клетки AGS и MKN-28.Секреция TGF-β1 измерялась через 0,1, 0,5, 1, 6, 12 и 24 часа после того, как оба типа клеток обрабатывались повышающимися концентрациями N-Shh или без них, и мы обнаружили, что она увеличивалась дозозависимым образом уже через 0,5 часа. после стимуляции N-Shh (рис. 4A). В ответ на добавление N-Shh максимальное увеличение секреции TGF-β1 наблюдалось через 12 и 24 часа после стимуляции N-Shh, при этом уровни в 13 раз превышали уровни необработанных клеток, наблюдаемые через 24 часа. Напротив, секреция TGF-β1 была заметно снижена в присутствии либо KAAD-циклопамина, либо антитела, блокирующего Shh (фиг. 4B).Однако контрольные эксперименты, в которых использовали контрольный носитель или антитело IgG, показали незначительные эффекты.
Рис. 4.
Сигнальный путь Shh индуцирует секрецию TGF-β и активирует индуцированный TGF-β транскрипционный ответ в клетках рака желудка. ( A ) Клетки AGS и MKN-28 помещали в шестилуночные планшеты, культивировали в бессывороточных условиях и затем обрабатывали увеличивающимися концентрациями N-Shh в течение указанного времени. После воздействия N-Shh анализируемые образцы были активированы кислотой, а затем были измерены уровни секретированного TGF-β, как описано в разделе «Материалы и методы».Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. Значения P рассчитывали путем сравнения обработанных клеток с необработанными контрольными клетками; * P <0,01, ** P <0,001. ( B ) Используя среду для роста, обработанную только N-Shh (0,5 мкг / мл) или вместе с увеличивающимися концентрациями KAAD-циклопамина, блокирующего анти-Shh или контрольного антитела IgG, мы измеряли уровни секретируемого TGF-β. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах.* P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно. ( C ) Клетки AGS временно трансфицировали 3TP-Lux (1 мкг) или CMV-renilla (1 мкг) с последующей обработкой увеличивающимися концентрациями N-Shh. Через 24 часа активность репортера 3TP-Lux измеряли с помощью люминометра и нормализовали до активности люциферазы Renilla . Столбцы представляют собой стандартное отклонение от трех независимых экспериментов.* P <0,01 по сравнению с необработанными контрольными клетками. ( D ) Клетки AGS, трансфицированные 3TP-Lux (1 мкг) или CMV-renilla (1 мкг), обрабатывали указанной концентрацией N-Shh в присутствии TGF-β (5 нг / мл). Затем клетки собирали через 24 часа и измеряли уровни люциферазы. Затем измеряли активность репортера 3TP-Lux и сообщали, как описано в (C). ** P <0,001 по сравнению с группами 5 нг / мл TGF-β. Клетки AGS ( E ) и MKN-28 ( F ), трансфицированные 3TP-Lux (1 мкг) или CMV-renilla (1 мкг), обрабатывали N-Shh (0.5 мкг / мл) или вместе с увеличивающимися концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид), анти-Shh, блокирующего TGF-β антитела или контрольного антитела IgG, и через 24 часа были измерены активности репортера 3TP-Lux, которые были представлены как описан в (C). * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Рис. 4.
Сигнальный путь Shh индуцирует секрецию TGF-β и активирует индуцированный TGF-β транскрипционный ответ в клетках рака желудка.( A ) Клетки AGS и MKN-28 помещали в шестилуночные планшеты, культивировали в бессывороточных условиях и затем обрабатывали увеличивающимися концентрациями N-Shh в течение указанного времени. После воздействия N-Shh анализируемые образцы были активированы кислотой, а затем были измерены уровни секретированного TGF-β, как описано в разделе «Материалы и методы». Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. Значения P рассчитывали путем сравнения обработанных клеток с необработанными контрольными клетками; * П <0.01, ** П <0,001. ( B ) Используя среду для роста, обработанную только N-Shh (0,5 мкг / мл) или вместе с увеличивающимися концентрациями KAAD-циклопамина, блокирующего анти-Shh или контрольного антитела IgG, мы измеряли уровни секретируемого TGF-β. Столбцы представляют собой стандартное отклонение трех независимых экспериментов, проведенных в трех экземплярах. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.( C ) Клетки AGS временно трансфицировали 3TP-Lux (1 мкг) или CMV-renilla (1 мкг) с последующей обработкой увеличивающимися концентрациями N-Shh. Через 24 часа активность репортера 3TP-Lux измеряли с помощью люминометра и нормализовали до активности люциферазы Renilla . Столбцы представляют собой стандартное отклонение от трех независимых экспериментов. * P <0,01 по сравнению с необработанными контрольными клетками. ( D ) Клетки AGS, трансфицированные 3TP-Lux (1 мкг) или CMV-renilla (1 мкг), обрабатывали указанной концентрацией N-Shh в присутствии TGF-β (5 нг / мл).Затем клетки собирали через 24 часа и измеряли уровни люциферазы. Затем измеряли активность репортера 3TP-Lux и сообщали, как описано в (C). ** P <0,001 по сравнению с группами 5 нг / мл TGF-β. Клетки AGS ( E ) и MKN-28 ( F ), трансфицированные 3TP-Lux (1 мкг) или CMV-renilla (1 мкг), обрабатывали N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями. KAAD-циклопамина, контрольного носителя (диметилсульфоксид), анти-Shh, блокирующего TGF-β антитела или контрольного антитела IgG, и через 24 часа измеряли и сообщали активности репортера 3TP-Lux, как описано в (C).* P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольным носителем и антителом IgG, соответственно.
Чтобы определить, вызывает ли N-Shh транскрипционную активность на промоторе, регулируемом TGF-β в клетках рака желудка, мы исследовали активность люциферазы TGF-β с использованием конструкции отчета промотора ингибитора активатора плазминогена-I, 3TP-Lux. Клетки AGS, трансфицированные 3TP-Lux, инкубировали в среде с увеличивающимися концентрациями N-Shh в течение 24 часов.Как видно на фиг. 4C, обработка N-Shh приводила к дозозависимому увеличению TGF-β-индуцированной активности 3TP-Lux; однако стимуляция клеток N-Shh более 0,5 мкг / мл не приводила к дополнительному увеличению активности люциферазы. Предварительная обработка экзогенным TGF-β1 также увеличивала активность 3TP-Lux в клетках AGS по сравнению с необработанным контролем (фигура 4D). Важно отметить, что клетки AGS, обработанные 5 нг / мл TGF-β1 и возрастающие концентрации N-Shh, показали более высокую активацию 3TP-Lux, чем клетки AGS, обработанные только TGF-β1.Следовательно, для дальнейшего тестирования влияния передачи сигналов Shh на транскрипционную активность TGF-β, клетки AGS, трансфицированные репортерной плазмидой 3TP-Lux, стимулировали в течение 24 часов либо блокирующим антителом против Shh, либо контрольным антителом IgG в присутствии N-Shh. Как показано на фиг. 4E, активность репортера 3TP-Lux, стимулированная N-Shh, блокировалась в присутствии блокирующего антитела против Shh, но не в присутствии контрольного антитела IgG. В соответствии со сниженной активностью репортера 3TP-Lux, которая наблюдалась в присутствии антитела, блокирующего Shh, KAAD-циклопамин полностью обращал усиление индуцированной TGF-β репортерной активности 3TP-Lux, которое было вызвано стимуляцией N-Shh.Аналогичные результаты были получены, когда клетки MKN-28 обрабатывались анти-Shh-блокирующими антителами или KAAD-циклопамином (фиг. 4F), и эти результаты хорошо совпадали с результатами экспериментов по миграции и инвазии клеток (фиг. 3), предполагая, что Shh- опосредованная индукция передачи сигналов TGF-β может играть роль в Shh-усиленной миграции клеток и инвазии в клетки рака желудка.
Shh способствует подвижности и инвазивности клеток рака желудка посредством TGF-β-опосредованной активации пути ALK5 – Smad 3
Затем, чтобы выяснить молекулярные механизмы, лежащие в основе стимулированного Shh ответа TGF-β в клеточной подвижности и инвазии клеток рака желудка, мы оценили экспрессию и активацию белков TβRII, ALK5, ALK1 и Smad и активацию TGF-β, чтобы определить, были ли они затронутый Н-шш.Экспрессию перечисленных выше белков тестировали за 0, 0,5, 1, 6, 12 и 24 ч до стимуляции N-Shh с помощью вестерн-блоттинга. Как показано на фиг. 5A, экспрессия белка ALK5 повышалась уже через 0,5 часа после обработки, и это повышение сохранялось в течение 24 часов после стимуляции N-Shh. Однако не было изменений в экспрессии белка ALK1 или TβRII, независимо от концентрации N-Shh. Подобно наблюдаемому увеличению экспрессии ALK5, было обнаружено, что фосфорилирование Smad 3 значительно усиливается в результате стимуляции N-Shh.Кроме того, стимуляция клеток AGS увеличивающимися концентрациями N-Shh показала, что экспрессия ALK5 и фосфорилирование Smad 3 увеличивались дозозависимым образом (фиг. 5C). Кроме того, повторное зондирование антителом, направленным против общего белка Smad 3, не выявило каких-либо значительных изменений в уровнях белка, что указывает на то, что наблюдаемое увеличение экспрессии не происходило в результате увеличения количества общего белка Smad 3. Однако не наблюдалось изменений в экспрессии Smad 2, 4, 6 или 7 независимо от присутствия различных концентраций N-Shh (данные не показаны).Чтобы определить, усиливает ли обработка N-Shh экспрессию ALK5 и фосфорилирование Smad 3 с помощью TGF-β, клетки AGS обрабатывали либо одним TGF-β1, либо увеличивающимися количествами N-Shh. Как и ожидалось, уровни экспрессии ALK5 и фосфорилирования Smad 3 в клетках, обработанных одновременно TGF-β1 и N-Shh, были выше, чем уровни экспрессии клеток, обработанных одним TGF-β (фиг. 5B). Чтобы дополнительно подтвердить влияние передачи сигналов Shh на экспрессию или активацию белка ALK5-Smad 3, мы ингибировали передачу сигналов Shh, обрабатывая клетки анти-Shh блокирующими антителами или KAAD-циклопамином, а затем выполнили вестерн-блот-анализ.Как экспрессия ALK5, так и фосфорилирование Smad 3 были заметно снижены в клетках, обработанных KAAD-циклопамином, по сравнению с клетками, обработанными N-Shh плюс контрольный носитель (фиг. 5C). Точно так же, когда сигнальный путь Shh был заблокирован с помощью блокирующих антител против Shh, наблюдалась пониженная экспрессия этих белков (фиг. 5D), предполагая, что передача сигналов Shh играет критическую роль в индукции ALK5 и фосфорилировании Smad 3.
Рис.5.
Потеря передачи сигналов ALK5 – Smad 3 коррелирует с Shh-индуцированной клеточной миграцией и инвазией. ( A ) Клетки AGS инкубировали в присутствии или в отсутствие 0,5 мкг / мл N-Shh в течение указанного времени, и общий белок собирали для вестерн-блот-анализа с использованием специфических антител против TβRII, ALK1, ALK5, p-Smad. 3, Smad 3 и β-актин. ( B ) Белковые экстракты клеток AGS, обработанных указанной концентрацией N-Shh в присутствии TGF-β (5 нг / мл), получали для вестерн-блоттинга, как в (A).Клетки AGS обрабатывали N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид) ( C ) , анти-Shh блокирующего антитела или контрольного антитела IgG ( D ) и Вестерн-блоттинг были затем выполнены для указанных антител. ( E ) Белковые экстракты клеток AGS, обработанных указанной концентрацией SB 431542, селективного ингибитора киназы ALK, в присутствии N-Shh (0,5 мкг / мл), были приготовлены для вестерн-блот-анализа с использованием специфических антител против ALK5. , p-Smad 3, Smad 3 и β-актин.Затем были обработаны клетки AGS и MKN-28, обработанные увеличивающимися концентрациями SB 431542 ( F ), миРНК ALK5, миРНК Smad 3 или неспецифической миРНК ( H ) в присутствии N-Shh (0,5 мкг / мл). оценивается с помощью анализа миграции и инвазии. Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * P <0,01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольный носитель и неспецифическая контрольная миРНК, соответственно.( G ) Экспрессия этих миРНК была подтверждена вестерн-блоттингом для ALK5 и Smad 3 соответственно.
Рис. 5.
Потеря передачи сигналов ALK5-Smad 3 коррелирует с Shh-индуцированной клеточной миграцией и инвазией. ( A ) Клетки AGS инкубировали в присутствии или в отсутствие 0,5 мкг / мл N-Shh в течение указанного времени, и общий белок собирали для вестерн-блот-анализа с использованием специфических антител против TβRII, ALK1, ALK5, p-Smad. 3, Smad 3 и β-актин.( B ) Белковые экстракты клеток AGS, обработанных указанной концентрацией N-Shh в присутствии TGF-β (5 нг / мл), получали для вестерн-блоттинга, как в (A). Клетки AGS обрабатывали N-Shh (0,5 мкг / мл) или вместе с возрастающими концентрациями KAAD-циклопамина, контрольного носителя (диметилсульфоксид) ( C ) , анти-Shh блокирующего антитела или контрольного антитела IgG ( D ) и Вестерн-блоттинг были затем выполнены для указанных антител. ( E ) Белковые экстракты клеток AGS, обработанные указанной концентрацией SB 431542, селективного ингибитора киназы ALK, в присутствии N-Shh (0.5 мкг / мл), готовили для вестерн-блоттинга с использованием специфических антител против ALK5, p-Smad 3, Smad 3 и β-актина. Затем были обработаны клетки AGS и MKN-28, обработанные увеличивающимися концентрациями SB 431542 ( F ), миРНК ALK5, миРНК Smad 3 или неспецифической миРНК ( H ) в присутствии N-Shh (0,5 мкг / мл). оценивается с помощью анализа миграции и инвазии. Данные выражены как среднее значение трех независимых экспериментов ± стандартное отклонение. * П <0.01 и ** P <0,001 по сравнению с клетками, обработанными N-Shh плюс контрольный носитель и неспецифическая контрольная миРНК, соответственно. ( G ) Экспрессия этих миРНК была подтверждена вестерн-блоттингом для ALK5 и Smad 3 соответственно.
Для дальнейшего выяснения роли передачи сигналов ALK5-Smad 3 в Shh-опосредованной миграции и инвазии мы заблокировали передачу сигналов TGF-β с помощью ингибитора киназы ALK5, SB 431542. Как показано на рисунке 5E, несмотря на присутствие добавленного N -Шш, обработка клеток AGS SB 431542 значительно снижает фосфорилирование Smad 3.Кроме того, закрытие раны и инвазивная активность в ответ на SB 431542 клетками AGS и MKN-28, обработанными N-Shh, были заблокированы (фиг. 5F). Мы также подавили ALK5 или Smad 3 в клетках AGS и MKN-28 с использованием ALK5- или Smad 3-специфической siRNA и проанализировали клеточную подвижность и инвазию. Эффективность этих миРНК для удаления экспрессии ALK5 или Smad 3 была подтверждена вестерн-блоттингом (фиг. 5G). Важно отметить, что временная экспрессия миРНК ALK5 или миРНК Smad 3 снижала способность N-Shh стимулировать миграцию и инвазию этих клеток по сравнению с клетками, обработанными неспецифической контрольной миРНК (фиг. 5H).Взятые вместе, эти результаты показывают, что передача сигналов Shh модулирует миграцию и инвазию клеток рака желудка через сигналы TGF-β, особенно активацию ALK5-Smad 3.
Передача сигналов Shh-TGF-β необходима для усиления MMP-2 и — 9 активность
Затем мы оценили Shh-опосредованную миграцию и инвазию клеток, чтобы определить, является ли это результатом повышенных уровней MMP, которые являются хорошо задокументированными ферментами, разрушающими внеклеточный матрикс, активность которых связана с инвазивностью опухоли.Чтобы измерить влияние передачи сигналов Shh на ММП, мы выполнили зимографию желатина с использованием кондиционированной среды, полученной из клеток AGS. Мы обнаружили, что супернатанты клеток AGS, обработанных N-Shh, содержали более высокие уровни активной формы MMP-2 (66 кДа) и MMP-9 (86 кДа) (фигура 6A). Чтобы дополнительно продемонстрировать, что передача сигналов Shh играет критическую роль в активности MMP-2 и -9, клетки AGS обрабатывали либо антителом, блокирующим Shh, либо KAAD-циклопамином, а затем тестировали на активность этих протеиназ.Явное снижение активности MMP-2 и -9 произошло после прекращения передачи сигналов Shh (фиг. 6C), предполагая, что Shh-опосредованная индукция MMP-2 и -9 может играть роль в Shh-усиленной миграции и инвазии клеток.
Рис. 6.
Передача сигналов Shh-TGF активирует активность MMP-2 и -9. ( A ) Кондиционированные среды из клеток AGS, обработанных возрастающими концентрациями N-Shh, собирали и анализировали на активность ММП с помощью желатиновой зимографии. Стандарт человеческого ММР-2 и -9 использовали в качестве положительного контроля.( B ) Клетки AGS обрабатывали возрастающими концентрациями N-Shh с TGF-β или без него (5 нг / мл) в течение 24 часов, а затем кондиционированные среды подвергали желатиновой зимографии. ( C ) Клетки AGS обрабатывали блокирующим антителом TGF-β (10 мкг / мл), SB431542 (10 мкМ), блокирующим антителом Shh (20 мкг / мл) или KAAD-циклопамином (10 мкМ) в присутствии N -Shh (0,5 мкг / мл) и кондиционированные среды подвергали желатиновой зимографии.
Рис. 6.
Передача сигналов Shh-TGF активирует активность MMP-2 и -9.( A ) Кондиционированные среды из клеток AGS, обработанных возрастающими концентрациями N-Shh, собирали и анализировали на активность ММП с помощью желатиновой зимографии. Стандарт человеческого ММР-2 и -9 использовали в качестве положительного контроля. ( B ) Клетки AGS обрабатывали возрастающими концентрациями N-Shh с TGF-β или без него (5 нг / мл) в течение 24 часов, а затем кондиционированные среды подвергали желатиновой зимографии. ( C ) Клетки AGS обрабатывали блокирующим антителом TGF-β (10 мкг / мл), SB431542 (10 мкМ), блокирующим антителом Shh (20 мкг / мл) или KAAD-циклопамином (10 мкМ) в присутствии N -Шш (0.5 мкг / мл) и кондиционированные среды подвергали желатиновой зимографии.
Приведенные выше результаты (фиг. 5) показывают, что передача сигналов Shh модулирует миграцию и инвазию клеток рака желудка посредством передачи сигналов TGF-β – ALK5 – Smad 3. Чтобы определить, является ли влияние передачи сигналов Shh на активности MMP-2 и -9 результатом усиления передачи сигналов TGF-β, клетки AGS обрабатывали либо одним TGF-β1, либо увеличивающимися количествами N-Shh. Зимография желатина показала повышенные уровни активной формы MMP-2 и -9 в ответ на одновременное лечение увеличивающимися количествами N-Shh по сравнению с одним TGF-β1 (фиг. 6B).Более того, активность MMP-2 и -9 полностью подавлялась воздействием на клетки блокирующего антитела против TGF-β или SB 431542, даже в присутствии N-Shh (фиг. 6C). Взятые вместе, результаты этих экспериментов показали, что передача сигналов TGF-β-ALK5-Smad 3 необходима для усиления активности MMP-2 и -9 с помощью передачи сигналов Shh.
Экспрессия Gli и ALK5 в опухолевой ткани человека в соответствии с метастазами в лимфатические узлы
Чтобы исследовать роль передачи сигналов Shh-TGF-β в метастазах рака желудка человека, мы выполнили иммуногистохимию Gli или ALK5 на биопсиях опухоли, полученных в общей сложности у 41 пациента с раком желудка, включая 32 образца метастазов в лимфатические узлы и 9 образцов без лимфатических узлов. -отрицательные образцы рака желудка.Экспрессия ALK5 классифицировалась как сильная, умеренная, слабая и отрицательная в 1 (2%), 9 (21%), 22 (53%) и 9 (21%) случаях. Экспрессия Gli была классифицирована как сильная, умеренная, слабая и отрицательная в 2 (4,8%), 16 (39%), 20 (48%) и 3 (7,3%) случаях соответственно. Характер экспрессии Gli был подобен экспрессии ALK5 в ткани опухоли желудка человека (фиг. 7). Паттерн экспрессии между Gli и ALK5 сильно коррелировал ( r = 0,439, P = 0,004). Несмотря на несущественный паттерн экспрессии ALK5 в ткани рака желудка человека в соответствии с метастазами в лимфатические узлы ( P = 0.752), Gli продемонстрировал тенденцию к высокой экспрессии в тканях желудка человека с метастазами в лимфатические узлы по сравнению с отсутствием метастазов в лимфатические узлы ( P = 0,094).
Рис. 7.
Gli и TGF-R показали сходный паттерн экспрессии в ткани рака желудка. Окраска ( A ) Gli, × 200 и окраска ( B ) ALK5 показали высокую экспрессию в той же области рака желудка, × 200.
Рис. 7.
Gli и TGF-R показали сходный паттерн экспрессии в ткани рака желудка.Окраска ( A ) Gli, × 200 и окраска ( B ) ALK5 показали высокую экспрессию в той же области рака желудка, × 200.
Обсуждение
Сигнальный путь Shh, хотя первоначально был признан за его роль в регуляции пролиферации клеток, образования тканей и дифференцировки клеток во время эмбриогенеза (1–4), недавно было показано, что он играет роль в пролиферации различных раковых клеток человека, включая BCC, медуллобластомы, мелкоклеточный рак легких, рак поджелудочной железы, рак простаты и рак желудка.Предыдущие исследования сообщили, что аберрантная активация передачи сигналов Shh через Ptch 1 часто обнаруживается в случаях прогрессирующей аденокарциномы желудка и что эта активация передачи сигналов была связана с плохо дифференцированными опухолями желудка. Эксперименты, проведенные на клетках рака желудка, также показали, что циклопамин, который ингибирует клеточные ответы на передачу сигналов Shh путем специфического связывания с Smo, может ингибировать злокачественный рост клеток рака желудка in vitro и in vivo .Взятые вместе, эти результаты указывают на то, что специфические ингибиторы сигнального пути Shh могут быть эффективны в будущем лечении рака желудка (6, 7). Несмотря на центральную роль, которую передача сигналов Shh играет в развитии рака желудка, мало что известно о предполагаемой функции, которую регуляция Shh играет в миграции и инвазии клеток. Здесь мы представили первые доказательства, подтверждающие новую функцию сигнального пути Shh как стимулирующего фактора в регуляции метастазирования опухоли.
Недавно несколько исследований подтвердили, что передача сигналов Shh играет роль в контроле подвижности нескольких типов клеток. Например, было показано, что передача сигналов Shh усиливает опосредованное эндотелиальными клетками-предшественниками ремоделирование микрососудов во время заживления ран (11) и важна для желточного мешка и эмбрионального васкулогенеза (12, 13). Кроме того, было показано, что нарушение передачи сигналов Shh циклопамином ингибирует ЕМП и уменьшает метастазирование в раковых клетках поджелудочной железы (31).Сверхэкспрессия Gli вызывает лимфатические метастазы, тогда как ингибирование передачи сигналов Shh снижает рост и подвижность клеток (32). Кроме того, результаты этого исследования также показывают, что активация передачи сигналов Shh связана с миграцией и инвазией клеток рака желудка. Кроме того, мы обнаружили, что миграция и инвазия клеток рака желудка вызываются стимуляцией N-Shh и блокируются путем отмены передачи сигналов Shh с помощью KAAD-циклопамина или блокирующих антител против Shh (Фигуры 1 и 2).Взятые вместе, эти данные предполагают, что аномальная активация этой передачи сигналов может способствовать метастазированию при различных раковых заболеваниях, включая рак желудка, и что ингибирование пути передачи сигналов Shh может быть полезным для предотвращения метастазирования. Однако механизмы, с помощью которых высокая экспрессия передачи сигналов Shh усиливает клеточную подвижность и инвазию, нуждаются в дальнейшем изучении.
Чтобы стать более инвазивным фенотипом, необходимо, чтобы эпителиальные раковые клетки приобрели миграционные и инвазивные способности, что затем приводит к способности миграции и инвазии через деградацию базальных мембран и внеклеточного матрикса в месте первичной опухоли и создание метастатических колоний в отдаленных органах (33, 34).Как правило, миграция и способность к инвазии положительно коррелируют с потенциалом метастазирования. На молекулярном уровне наблюдается измененная экспрессия эпителиальных маркеров и повышенная экспрессия белков, участвующих в миграции и инвазии клеток (35, 36). Недавнее исследование продемонстрировало, что передача сигналов Hh коррелирует с тяжестью ассоциированной опухоли и что этой активности достаточно для поддержания метастатического поведения (10–14). Здесь мы сообщаем, что сигнальный путь Shh может вызывать метастатические функции рака желудка через механизм подвижности и инвазии опухолевых клеток.Однако метастатические эффекты передачи сигналов Shh требуют дальнейшего изучения.
Было обнаружено, что процессы миграции и инвазии клеток, а также экспрессия связанных с ними белков регулируются несколькими сигнальными путями, включая TGF-β (37, 38). Хотя TGF-β проявляет большую часть своей опухолевой супрессорной активности за счет мощного ингибирования пролиферации многих раковых клеток, в нескольких исследованиях ранее указывалось, что TGF-β участвует в прогрессировании рака на основании его вклада в инвазию опухоли, его подавления иммунного ответа и его влияния. изменение микросреды опухоли (22, 26, 28).Wang et al. (30) сообщил, что TGF-β может модулировать метастатический потенциал клеток рака желудка, способствуя их подвижной и инвазивной активности. В этом исследовании мы показали, что передача сигналов Shh играет важную роль в подвижности и инвазивности клеток рака желудка и что это происходит через сигнальный путь TGF-β. Основываясь на этих результатах, мы оценили внутриклеточный перекрестный обмен между TGF-β и сигнальным путем Shh, чтобы определить, играет ли он важную роль в метастатическом потенциале рака желудка, и обнаружили, что очень тесная положительная корреляция между TGF-β и Shh сигнальные пути существовали.Интересно, что мы обнаружили, что активация сигнального пути Shh в клетках рака желудка индуцирует секрецию TGF-β1, регулируемую TGF-β транскрипционную активность, TGF-β-опосредованную миграцию и TGF-β-опосредованную инвазию после лечения N-Shh (Рисунок 3 ). Кроме того, мы обнаружили, что блокирование передачи сигналов TGF-β блокирующим антителом против TGF-β или миРНК TGF-β1 делает клетки рака желудка невосприимчивыми к Shh-опосредованной миграции и инвазии, что указывает на то, что сигнальный путь TGF-β модулирует передачу сигналов Shh в желудке. миграция и инвазия рака.
Чтобы лучше понять механизм, с помощью которого TGF-β индуцировал Shh-опосредованную миграцию и инвазию, мы оценили эти эффекты, чтобы определить, опосредуются ли они через различные рецепторы TGF-β типа I. Мы обнаружили, что стимуляция N-Shh клеток рака желудка индуцировала экспрессию ALK5, но не TβRII и ALK1, тогда как обработка KAAD-циклопамином или блокирующим антителом против Shh приводила к значительному снижению экспрессии ALK5. ALK1 передает сигнал через Smad 1/5, тогда как ALK5 передает сигнал через Smad 2/3.В частности, было обнаружено, что клетки рака желудка, обработанные N-Shh, демонстрируют значительное увеличение фосфорилирования Smad 3 (фиг. 5), но не блокируют фосфорилирование Smad 2 или Smad 1/5 (данные не показаны). Однако дополнительная обработка SB 431542, миРНК ALK5 или миРНК Smad 3 привела к значительному снижению количества фосфорилированного Smad 3 и полностью изменила подвижные и инвазивные эффекты передачи сигналов Shh на эти клетки. Взятые вместе, эти результаты убедительно подтверждают, что подвижная и инвазивная активность Shh в отношении клеток рака желудка может быть отнесена к ALK5 / Smad 3.Однако точный механизм, с помощью которого сигнальный путь Shh контролирует функцию TGF-β-ALK5, чтобы регулировать Shh-опосредованный метастатический потенциал, нуждается в дальнейшем изучении.
Члены семейства Gli, которые являются медиаторами транскрипции передачи сигналов Shh, опосредуют ответ Shh. Когда Shh связывается с рецептором Ptch, инактивированный Ptch активирует передачу сигналов через Smo. Это заставляет Gli, который выделяется Smo из большого белкового комплекса, перемещаться в ядро для активации генов-мишеней Shh (3, 5).Недавно было показано, что Gli влияет на экспрессию гена BMP-2, который структурно связан с суперсемейством TGF-β в остеобластах (39). Интересно отметить, что мы обнаружили, что передача сигналов Shh не приводила к изменениям в экспрессии гена TGF-β рецептора II или ALK1, тогда как усиление экспрессии гена ALK5 индуцировалось стимуляцией N-Shh (данные не показаны). Следовательно, передача сигналов Shh нуждается в дальнейшей оценке, чтобы определить, влияет ли она на активность промотора ALK5 посредством физического взаимодействия между белком Gli и специфической областью промотора ALK5.
Итак, наши находки подчеркивают потенциальную роль передачи сигналов TGF-β-ALK5 в Shh-индуцированной клеточной миграции и инвазии. Эти наблюдения улучшают наше понимание механизма, с помощью которого происходит активация передачи сигналов Shh, поскольку он связан с метастатическим поведением клеток рака желудка, что может оказаться полезным для идентификации терапевтических молекулярных мишеней для ингибирования Shh-зависимой миграции и инвазии.
Финансирование
Грант Корейского университета.
Сокращения
ALK
активин-рецептор-подобная киназа
Hh
MMP
PBS
фосфатно-солевой буфер
si
si
TGF
трансформирующий фактор роста
TβRII
Аббревиатуры
Заявление о конфликте интересов: Не заявлено.
Список литературы
1., et al.
Роль в развитии и клиническое значение передачи сигналов hedgehog
,
Curr. Вершина. Dev. Биол.
,
2003
, т.
53
(стр.
1
—
114
) 2., Et al.
Общение с ежиками
,
Нац. Rev. Mol. Клетка. Биол.
,
2005
, т.
6
(стр.
306
—
317
) 3., Et al.
Передача сигналов Hedgehog в развитии животных: парадигмы и принципы
,
Genes Dev.
,
2001
, т.
15
(стр.
3059
—
3087
) 4. И др.
Передача сигналов Hedgehog в формировании и поддержании рака
,
Nat. Rev. Cancer
,
2003
, vol.
3
(стр.
903
—
911
) 5., Et al.
Путь hedgehog и базальноклеточный рак
,
Hum. Мол. Genet.
,
2001
, т.
10
(стр.
757
—
762
) 6., Et al.
Передача сигналов Hedgehog в регенерации, неоплазии и метастазировании простаты
,
Nature
,
2004
, vol.
431
(стр.
707
—
712
) 7., Et al.
Восстановление тканей и обновление стволовых клеток в канцерогенезе
,
Nature
,
2004
, vol.
432
(стр.
324
—
331
) 8., Et al.
Ингибирование передачи сигналов hedgehog путем прямого связывания циклопамина с Smoothened
,
Genes Dev.
,
2002
, т.
16
(стр.
2743
—
2748
) 9. И др.
Модуляция сглаженной активности низкими молекулами
,
Proc.Natl Acad. Sci. США
,
2002
, т.
99
(стр.
14071
—
14076
) 10. И др.
Постнатальная рекапитуляция эмбрионального пути ежа в ответ на ишемию скелетных мышц
,
Circulation
,
2003
, vol.
108
(стр.
479
—
485
) 11., Et al.
Актуальная ультразвуковая генная терапия hedgehog ускоряет заживление ран при диабете за счет усиления опосредованного эндотелиальными клетками-предшественниками ремоделирования микрососудов
,
Circulation
,
2006
, vol.
113
(стр.
2413
—
2424
) 12. И др.
Передача сигналов Hedgehog необходима для образования взрослых стволовых клеток крови у эмбрионов рыбок данио
,
Dev. Ячейка
,
2005
, т.
8
(стр.
389
—
400
) 13., Et al.
Передача сигналов Hedgehog важна для образования эндотелиальной трубки во время васкулогенеза
,
Development
,
2004
, vol.
131
(стр.
4371
—
4380
) 14., и другие.
Молекулярные пути, регулирующие промиграционные эффекты передачи сигналов hedgehog
,
J. Biol. Chem.
,
2006
, т.
281
(стр.
33860
—
33870
) 15 ..
Передача сигнала TGF-beta
,
Annu. Rev. Biochem.
,
1998
, т.
67
(стр.
753
—
791
) 16., Et al.
Факторы транскрипции Smad
,
Genes Dev.
,
2005
, т.
19
(стр.
2783
—
2810
) 17., Et al.
Механизмы передачи сигналов TGF-beta от клеточной мембраны к ядру
,
Cell
,
2003
, vol.
113
(стр.
685
—
700
) 18., Et al.
Трансдукция сигнала трансформирующего фактора роста бета при ангиогенезе и сосудистых заболеваниях
,
Chest
,
2005
, vol.
128
(стр.
585S
—
590S
) 19., Et al.
Трансгенные мыши, сверхэкспрессирующие доминантно-отрицательный мутантный мутантный бета-рецептор трансформирующего фактора роста II, демонстрируют усиленный туморогенез в молочной железе и легких в ответ на канцероген 7,12-диметилбенз- [a] -антрацен
,
Cancer Res.
,
1997
, т.
57
(стр.
5564
—
5570
) 20., Et al.
Подавление опухоли молочной железы путем трансформации экспрессии трансгена фактора роста бета 1
,
Proc. Natl Acad. Sci. США
,
1995
, т.
92
(стр.
4254
—
4258
) 21., Et al.
Трансгенные мыши, экспрессирующие доминантно-отрицательный мутантный мутантный рецептор трансформирующего фактора роста-бета типа II, демонстрируют нарушение развития молочной железы и усиленное образование опухоли молочной железы.
,
Am.J. Pathol.
,
2003
, т.
163
(стр.
1539
—
1549
) 22., Et al.
ALK5 способствует ангиогенезу опухоли путем активации матриксной металлопротеиназы-9 в опухолевых клетках
,
Онкоген
,
2006
23., et al.
Передача сигналов аутокринного трансформирующего фактора роста-бета опосредует Smad-независимую подвижность в раковых клетках человека
,
J. Biol. Chem.
,
2003
, т.
278
(стр.
3275
—
3285
) 24., и другие.
Smad-зависимые и Smad-независимые пути передачи сигналов в семействе TGF-бета
,
Nature
,
2003
, vol.
425
(стр.
577
—
584
) 25., Et al.
Повышенная злокачественность опухолей молочной железы, индуцированных Neu, сверхэкспрессирующих активный трансформирующий фактор роста бета1
,
Мол. Клетка. Биол.
,
2003
, т.
23
(стр.
8691
—
8703
) 26., Et al.
Активированная киназа рецептора TGFbeta типа I увеличивает выживаемость эпителиальных клеток молочной железы и ускоряет прогрессирование опухоли
,
Онкоген
,
2006
, vol.
25
(стр.
3408
—
3423
) 27., Et al.
p53-независимая негативная регуляция белка 1, взаимодействующего с p21 / циклин-зависимой киназой, с помощью связанного с акустическим хэджхог-глиомой онкогена 1 в клетках карциномы желудка
,
Cancer Res.
,
2005
, т.
65
(стр.
10822
—
10829
) 28., Et al.
Трансформирующий фактор роста бета и рак груди: способствующие развитию опухолей эффекты трансформирующего фактора роста бета
,
Breast Cancer Res.
,
2000
, т.
2
(стр.
125
—
132
) 29., Et al.
Передача сигналов TGF-бета: положительные и отрицательные эффекты на онкогенез
,
Curr. Opin. Genet. Dev.
,
2002
, т.
12
(стр.
22
—
29
) 30., Et al.
Повышение метастатической и инвазивной способности клеток рака желудка путем трансформации фактора роста-бета1
,
Acta Biochim. Биофиз. Грех. (Шанхай)
,
2006
, т.
38
(стр.
179
—
186
) 31., Et al.
Блокада передачи сигналов hedgehog подавляет инвазию и метастазы рака поджелудочной железы: новая парадигма комбинированной терапии солидных злокачественных опухолей
,
Cancer Res.
,
2007
, т.
67
(стр.
2187
—
2196
) 32., Et al.
Экспрессия Gli-1 связана с метастазами в лимфатические узлы и прогрессированием опухоли при плоскоклеточном раке пищевода
,
Oncology
,
2006
, vol.
70
(стр.
378
—
389
) 33., Et al.
Переход между эпителием и мезенхимой во время развития нервного гребня
,
Acta Anat. (Базель)
,
1995
, т.
154
(стр.
63
—
78
) 34., Et al.
Сложные сети организуют эпителиально-мезенхимальные переходы
,
Nat. Rev. Mol. Клетка. Биол.
,
2006
, т.
7
(стр.
131
—
142
) 35., Et al.
NF-kappaB необходим для эпителиально-мезенхимального перехода и метастазирования в модели прогрессирования рака груди
,
J.Clin. Вкладывать деньги.
,
2004
, т.
114
(стр.
569
—
581
) 36., Et al.
Связь повышенной инвазивности базальной мембраны с отсутствием рецептора эстрогена и экспрессией виментина в клеточных линиях рака молочной железы человека
,
J. Cell. Physiol.
,
1992
, т.
150
(стр.
534
—
544
) 37., Et al.
Преобразование передачи сигналов бета-фактора роста при инвазии и метастазировании рака
,
Int.J. Cancer
,
2007
, т.
121
(стр.
2119
—
2124
) 38., Et al.
TGF-beta и эпителиально-мезенхимальные переходы
,
Онкоген
,
2005
, т.
24
(стр.
5764
—
5774
) 39., Et al.
Фактор транскрипции цинкового пальца Gli2 опосредует экспрессию костного морфогенетического белка 2 в остеобластах в ответ на передачу сигналов hedgehog
,
Mol. Клетка. Биол.
,
2006
, т.
26
(стр.
6197
—
6208
)
© Автор 2008. Опубликовано Oxford University Press. Все права защищены. За разрешениями обращайтесь по электронной почте: [email protected]
Онлайн-версия этой статьи была опубликована в рамках модели открытого доступа. Пользователи имеют право использовать, воспроизводить, распространять или демонстрировать версию этой статьи в открытом доступе в некоммерческих целях при условии, что: исходное авторство правильно и полностью указано; Журнал и Издательство Оксфордского университета указываются как место первоначальной публикации с указанием правильных сведений о цитировании; если статья впоследствии воспроизводится или распространяется не полностью, а только частично или как производная работа, это должно быть четко указано.По вопросам коммерческого повторного использования обращайтесь по адресу [email protected]
Сигнальный домен sonic hedgehog в адвентиции артерии поддерживает резидентные Sca1 + клетки-предшественники гладких мышц
Аннотация
Мы охарактеризовали сигнальный домен sonic hedgehog (Shh), ограниченный адвентициальным слоем стенки артерии, который поддерживает резидентные Sca1-положительные клетки-предшественники сосудов (AdvSca1). При использовании репортерных мышей patched-1 ( Ptc1 lacZ ) и patched-2 ( Ptc2 lacZ ) адвентициальная сигнальная активность Shh была впервые обнаружена в эмбриональный день (E) 15.5, достигал наивысших уровней между 1-м постнатальным днем (P1) и P10, уменьшался в сосудах взрослых и совместно локализовался с кольцевым кольцом белка Shh, размещенным между средой и адвентицией. В Тс
У мышей — / — клетки AdvSca1, обычно обнаруживаемые в корне аорты, либо отсутствовали, либо были значительно уменьшены в количестве. Используя маркер линии Wnt1-cre , который идентифицирует клетки происхождения нервного гребня, мы обнаружили, что ни адвентиция, ни AdvSca1 клетки не были помечены в артериях, состоящих из происходящих из нервного гребня гладкомышечных клеток (SMC).Хотя клетки AdvSca1 не экспрессируют маркерные белки SMC in vivo , они действительно экспрессируют факторы транскрипции, которые, как считается, необходимы для дифференцировки SMC, включая сывороточный фактор ответа (SRF) и членов семейства миокардинов, и легко дифференцируются в SMC-подобные клетки in vitro. . Однако клетки AdvSca1 также экспрессируют мощные репрессоры SRF-зависимой транскрипции, включая Klf4, Msx1 и FoxO4, которые могут быть критическими для поддержания фенотипа предшественников SMC клеток AdvSca1 in vivo .Мы пришли к выводу, что ограниченный домен передачи сигналов Shh локализован в адвентиции артерий и может играть важную роль в поддержании резидентных сосудистых клеток-предшественников SMC в стенке артерии.
Адвентиция окружает большинство кровеносных сосудов, где она функционирует как динамический отсек для переноса клеток в стенку артерии и из нее. Адвентиция — это место образования и регресса микрососудов, которые проникают и питают медиальный и интимальный слои стенки сосуда (1–3).Адвентиция также содержит периваскулярные нервы и лимфатические сосуды и является важным доменом для активности NAD (P) H оксидазы в стенке сосуда (4). Адвентициальные клетки участвуют в росте и восстановлении сосудов и являются важными детерминантами размера просвета через контроль процессов ремоделирования внутренней или внешней стенки (2, 5). Недавние исследования сообщают о неожиданной роли адвентиции, поскольку она поддерживает резидентные клетки-предшественники, которые могут принимать как сосудистые, так и несосудистые судьбы (6-8). Несмотря на эти важные функциональные свойства, сигналы и сигналы окружающей среды, которые придают такие уникальные и динамические свойства адвентициальному слою, остаются в значительной степени неизвестными.
Звуковой еж (Shh) — важный морфоген и фактор роста для многих развивающихся тканей (9). В сосудистой системе передача сигналов Shh важна для спецификации артериально-венозной идентичности эндотелиальных клеток (10), ремоделирования кровеносных сосудов желточного мешка (11) и рекрутирования муральных клеток (12). В кровеносных сосудах взрослых Shh является ангиогенным при ишемии задних конечностей и микрокарманами роговицы (13, 14), способствует периневральной неоваскуляризации у животных с диабетом (15) и защищает миокард от хронической ишемии (16).Shh стимулирует продукцию ангиогенных факторов, включая VEGF-A и ангиопоэтин-1, интерстициальными фибробластами (13, 14), а также способствует хемотаксису эндотелиальных клеток и образованию трубок (17, 18). Следовательно, Shh играет важную роль в межклеточной коммуникации во время развития сосудов и заживления ран у взрослых.
Белки Hedgehog (Hh) передают сигнал путем связывания с рецепторами patched-1 (Ptc1) или patched-2 (Ptc2) и дополнительными белками cdo / boc на поверхности клетки, что приводит к дерепрессии сглаженного (smo) (19).Белки Ptc представляют собой рецепторы с 12-трансмембранными доменами, которые структурно связаны с семейством резистентных клубеньков-делений (RND) бактериальных мембранных пермеаз (20) и переносчиком холестерина C1-like1 Ниманна-Пика (21). Белки Ptc содержат консервативный домен, чувствительный к стеролам, и недавние исследования показывают, что Ptc1 репрессирует smo, транспортируя активирующие стеролы из клетки (22). Связывание Hh с Ptc1 ингибирует активность переносчика, тем самым позволяя накапливаться активирующим стеролам (19, 22).Активированный трафик smo поступает в первичные реснички, где сконцентрированы медиаторы сигнала Hh (23, 24), и запускает фосфорилирование факторов gli, которые затем перемещаются в ядро и стимулируют транскрипцию генов (25). Среди генов-мишеней Hh есть Ptc1 и Ptc2 ; следовательно, активности Ptc1 lacZ и Ptc2 lacZ используются в качестве чувствительных репортеров передачи сигналов Hh у трансгенных мышей (26, 27).
Происхождение и функции адвентиции плохо изучены.Hu et al. (6) сообщил, что стволовые клетки, антиген-1 (Sca1) -положительные клетки, способные дифференцироваться в гладкомышечные клетки (SMC), были обнаружены в адвентиции аорты взрослых ApoE
— / — мышей (клетки AdvSca1). При переносе на адвентициальную сторону экспериментальных венозных трансплантатов SMC, полученные из AdvSca1, составляли 30% клеток в неоинтиме трансплантата через 4 недели (6). Адвентиция отвечает на повреждение баллонного катетера быстрым увеличением экспрессии SMαActin и SM22α, особенно на границе медиа-адвентиция (5).Сообщается, что эндотелиальные клетки-предшественники группируются между средой и адвентицией в артериях человека (7, 8). Эти клетки сформировали капиллярные отростки в анализах ex vivo кольцевых культур и были задействованы опухолевыми клетками для образования капиллярных сосудов in vivo . Учитывая роль передачи сигналов Shh в поддержании резидентных стволовых клеток и клеток-предшественников в коже (28), нервной системе (29), лимфоидной ткани (30) и гематопоэтических клетках (31), мы стремились проверить аналогичную роль передачи сигналов Hh. в адвентициальной ткани, окружающей кровеносные сосуды.
Результаты
Hh-сигнализация в послеродовых кровеносных сосудах.
Мы исследовали активность β-гал в кровеносных сосудах трансгенных мышей Ptc lacZ на постнатальный день 2 (P2). В целом сердце активность Ptc1 lacZ и Ptc2 lacZ была обнаружена в коронарных артериях, но не в миокарде или эпикарде (рис.
А ).Восходящая аорта и легочный ствол в это время были сильно положительными (рис. 1).
А ). Активность Ptc1 lacZ и Ptc2 lacZ снижалась с возрастом и была обнаружена на низких уровнях в коронарных артериях и поперечной аорте взрослых мышей (рис.
В ). В поперечных срезах аорты в точке P2 сильная активность Ptc1 lacZ была ограничена адвентицией, и только иногда положительные клетки обнаруживались в среде или интиме (рис.1
С ). Адвентициальная активность Ptc1 lacZ также была обнаружена в межреберных (рис.
D ) и бедренной (рис.1
F ) артерии. В брыжеечной артерии окрашивание артерий Ptc1 lacZ было более интенсивным, чем окрашивание вен (рис.
E ), тогда как лимфатические сосуды были отрицательными [вспомогательная информация (SI) Рис. S1]. Активность Ptc2 lacZ демонстрировала очень похожие паттерны (рис.1
D – F Правый и рис. S2). Т.о., активная передача сигналов Hh была обнаружена в крупных и средних артериях и венах в перинатальном периоде и локализована в адвентиции этих сосудов.
Рисунок 1.
Сигнал Hh в стенке артерии.( A , B и D – F ) Ткани выделяли из мышей Ptc lacZ на P2 и окрашивали на активность β-gal. Все осмотренные основные артерии, включая коронарные артерии, аорту, легочный ствол ( A ), межреберные ( D ), брыжеечные ( E ) и бедренные артерии ( F ), дали положительный результат на Ptc1 lacZ или активность Ptc2 lacZ , как показано. ( B ) Взрослые сердца демонстрировали низкие уровни активности β-гал в коронарных артериях, аорте и легочной артерии.( C ) Поперечный разрез аорты в точке P2 показывает, что Ptc1 lacZ -положительные клетки ограничены адвентицией. Ика, межреберная артерия; А — артерия; V, вена; N, нерв. (Увеличение: A и D – F , × 7; B , × 3; C, × 40.)
Тссс в Адвентиции.
Белок
Shh был локализован на границе между средой и адвентицией в крупных и средних артериях через 2 дня после рождения (рис.2
А ). Этот паттерн распределения Shh колокализован как с Ptc1, , так и с lacZ (рис.
C и 2
B Inset ) и Ptc2 lacZ действий. Мы не смогли обнаружить индийского ежа (Ihh) в послеродовых артериях и обнаружили только низкие уровни пустынного ежа (Dhh) в эндотелии (данные не показаны). Эти результаты показывают, что активность Ptc1 lacZ и Ptc2 lacZ в стенке артерии коррелирует с локализованным отложением белка Shh в периферическом кольце во внеклеточном матриксе (ECM) в пространстве между средой и адвентицией (рис. .2
А ).
Рис. 2.
Распределение клеток Shh и Sca1 + в адвентиции. ( A ) Белок Shh обнаружен за пределами внешней эластической пластинки аорты (отмечен зеленой автофлуоресценцией) в точке P2. ( B ) Белок Shh (красный) находится между средой (SMαActin, зеленый) и адвентицией нисходящей аорты.( B Вставка ) Shh (красный) колокализуется с β-gal в срезах аорты мышей Ptc1 lacZ . ( C ) Клетки Sca1 + (красные) находятся вне среды (SMαActin, зеленый) в аорте P2. ( D ) Клетки Sca1 + (зеленые) находятся в непосредственной близости от Shh (красный) и встроены в β-gal-положительный домен (, вставка ) в адвентицию аорты от мышей Ptc1 lacZ . ( E ) Сосуды брыжейки окрашены на SMαActin (зеленый) и Shh (красный).( F ) Бедренные артерии окрашены на SMαActin (зеленый) и Sca1 (красный). Изображения представляют собой сложенные сечения в Z-плоскости из конфокальной микроскопии. Адвентициальная локализация клеток Sca1 + коррелирует с распределением белка Shh и активной передачи сигналов Shh in vivo .
Sca1-положительных клеток в адвентиции.
В предыдущем сообщении (6) описаны клетки Sca1 + в адвентиции, окружающей корень аорты у взрослых ApoE
— / — мышей.Одна из возможных ролей Shh, следовательно, может заключаться в поддержании клеток-предшественников Sca1 + в этом домене стенки артерии. Как показано на рис. 2
Клетки C , Sca1 + ограничены адвентицией (клетки AdvSca1) и обнаруживают небольшое перекрытие или полное отсутствие перекрытия с SMαActin-позитивными клетками в среде. Аналогичное распределение было обнаружено в брыжеечной и бедренной артериях (рис. 2).
E и F ). Была обнаружена тесная близость между белком Shh и клетками AdvSca1 (рис.2
D ). Обширное перекрытие наблюдалось между β-gal-положительными клетками и клетками AdvSca1 в адвентиции аорты мышей Ptc1 lacZ (рис.
D Вставка ). Эти находки подтверждают, что зона передачи сигналов Shh в адвентиции идентифицирует уникальный домен стенки артерии, внутри которого обнаруживаются резидентные Sca1 + клетки-предшественники сосудов in vivo .
Анализ изолированных клеток AdvSca1.
Клетки
AdvSca1 выделяли путем иммуноселекции и исследовали на маркеры клеток-предшественников. Клетки AdvSca1 показали набор CD34 + / c-
— / CD140b + маркерный профиль (рис.
A ) и были отрицательными по CD45 и CD68 (данные не показаны), аналогично профилю, описанному Hu et al. (6). Свежевыделенные клетки AdvSca1 последовательно экспрессировали маркеры передачи сигналов Shh, включая ptc1, ptc2, smo, gli1, gli2 и gli3 (рис.3
А ). Распределение Shh во внеклеточном пространстве регулируется множеством связывающих и транспортных белков, включая взаимодействующий с hedgehog белок-1 (Hhip1), cdo и boc (см. Ссылку 19), все из которых экспрессируются клетками AdvSca1 (рис. 3).
А ). Кроме того, клетки AdvSca1 содержат мРНК для Shh с небольшим количеством транскриптов, обнаруживаемых для Dhh или Ihh (если таковые имеются) (рис.
А ). Эти результаты подтверждают, что клетки AdvSca1 как продуцируют Shh, так и отвечают на него, и что ограниченное распределение Shh в стенке артерии частично локально контролируется факторами, продуцируемыми самими клетками AdvSca1.
Рис 3.
Анализ клеток AdvSca1. ( A ) Анализ RT-PCR клеток AdvSca1 из взрослых артерий. ( B ) Свежевыделенные клетки AdvSca1 (красные) содержат SRF (зеленый), колокализованные с ядрами, окрашенными DAPI (синие) (стрелки). ( C ) Свежевыделенные клетки AdvSca1 (красный) содержат Klf4 (зеленый), колокализованный с ядрами, окрашенными DAPI (синий) (стрелки).( D ) Анализ ОТ-ПЦР клеток AdvSca1, культивированных в течение 0, 12 или 28 дней. М — общая РНК из среды аорты, используемая в качестве положительного контроля для маркеров SMC. Этот анализ был проведен трижды с аналогичными результатами. ( E ) Клетки AdvSca1 культивировали в среде, содержащей сыворотку, в течение 9 дней. Многие клетки подавляют ScaI (красный) и активируют SMαActin (зеленый). (Увеличение: B и C , × 40; E , × 10.)
Hu et al. (6) сообщил, что клетки AdvSca1 дифференцируются в SMC при инкубации с PDGF-BB (6). Мы обнаружили, что при культивировании в среде DMEM, содержащей 10% сыворотки, многие клетки AdvSca1 (≈30–50%) утратили экспрессию Sca1, приобрели экспрессию SMαActin, SM22α, кальпонина и SM-MHC и приняли удлиненную форму мезенхимальных клеток (рис. . 3
D и E ). Чтобы исключить возможность того, что повышающая регуляция маркеров SMC является результатом увеличения пула медиальных SMC, перенесенных при выделении клеток AdvSca1, мы повторили наши эксперименты в присутствии ингибиторов пролиферации клеток (афидиколина или гидроксимочевины).После проверки остановки роста мы наблюдали повышающую регуляцию маркерных белков SMC в течение аналогичного периода времени и в той же степени, что и в отсутствие ингибиторов клеточного цикла (рис. S3). Мы пришли к выводу, что клетки AdvSca1 могут напрямую дифференцироваться в SMC-подобные клетки, и что эта дифференцировка не требует пролиферации клеток.
Клетки
AdvSca1 не экспрессируют маркерные белки SMC in vivo (рис. 2 и 4). Однако они содержат мРНК факторов транскрипции, участвующих в дифференцировке SMC, включая сывороточный фактор ответа (SRF), членов семейства миокардинов и богатые цистеином белки LIM Csrp1 и Csrp2 (рис.3
А ). Кроме того, подмножество свежевыделенных ядер клеток AdvSca1 было иммунопозитивным в отношении белка SRF (рис. 3).
В ). Однако клетки AdvSca1 также экспрессируют мощные сайленсеры SRF-зависимой транскрипции, включая Msx1, Klf4 и FoxO4 (рис.
D и данные не показаны). Каждый из этих факторов может ингибировать SRF и миокардин-зависимую экспрессию гена SMC (32, 33), и они подавляются, поскольку клетки AdvSca1 приобретают маркеры SMC и увеличивают экспрессию коактиватора SRF (рис.3
D ). Следовательно, подмножество клеток AdvSca1 может поддерживаться в качестве предшественников SMC за счет экспрессии сайленсеров SRF-зависимой транскрипции. Когда клетки AdvSca1 инкубировали с VEGF-A (10 нг / мл, 9 дней), кластеры PECAM1-положительных эндотелиальных клеток появлялись в удлиненных тяжах, которые часто колокализовались с SMαActin-положительными клетками (рис. S4). При инкубации с BMP2 (50 нг / мл, 20 дней) образовывались колонии, окрашенные ализариновым красным или красителем фон Коссы, что соответствовало дифференцировке подмножества клеток AdvSca1 в остеогенные клетки (рис.S4). В условиях, описанных выше, 30-50% клеток AdvSca1 дифференцировались в SMC-подобные клетки, ≈10% продуцировали эндотелиальные клетки и 1-5% образовывали остеогенные колонии in vitro .
Рис. 4.
клеток AdvSca1 в развивающейся аорте. ( A – F ) Ткани получали в указанные моменты времени.Поперечные срезы корня аорты окрашивали на Sca1 (красный), SMαActin (зеленый) и DAPI (синий). Клетки AdvSca1 сначала появляются между E15.5 и E18.5 в адвентициальном пространстве между аортой и легочным стволом (белые стрелки на C ) и сохраняются в этом месте в зрелом возрасте. ( G ) Поперечный срез корня аорты Wnt1-cre / R26R (возраст 5 недель), окрашенный на активность β-gal и ядерно-быстрый красный. SMC (синие), но не адвентициальные клетки, происходят из нервного гребня. Пунктирная рамка показана при большем увеличении в H .( H ) Поперечный разрез корня аорты не показывает перекрытия между β-gal-положительными и AdvSca1 + клетками. АО, аорта; ПТ, легочный ствол. (Шкала увеличения в E относится к A – F; G, × 10.)
Истоки развития клеток AdvSca1.
Эксперименты по восстановлению костного мозга ранее показали, что клетки AdvSca1 не происходят из костного мозга (6). Чтобы понять происхождение клеток AdvSca1 in vivo , мы исследовали мышей с 12-го дня эмбриона.С 5 (E12.5) до 12 недель после рождения. Клетки AdvSca1 впервые появились в периваскулярном пространстве между восходящей аортой и легочным стволом между E15.5 и E18.5 (рис. 4).
C , стрелки), спустя много времени после того, как оболочка медиума приобрела SMC и организовала полный набор эластичных ламелей. Клетки AdvSca1 присутствовали в этом положении во все последующие исследуемые моменты времени, и их количество увеличивалось с постнатальным ростом стенки артерии (рис. 4).
D – F ).Затем мы использовали трансгенных мышей Wnt1-cre для мечения клеток происхождения нервного гребня (34). Wnt1-cre -активированный репортер β-gal метил полученные из нервного гребня SMC в проксимальном отделе аорты, легочном стволе, общих сонных артериях и артериальном протоке, но не метил клетки AdvSca1 в этих сосудах (рис. 4).
G и H ).
Анализ клеток AdvSca1 в эмбрионах Shh
— / — .
Чтобы определить, требуется ли Shh для образования или поддержания клеток AdvSca1, мы исследовали Shh
— / — мышей.Были изучены два анатомически определенных участка. Присутствие клеток AdvSca1 в корне аорты, где они впервые обнаруживаются во время развития (рис. 4).
C ) и наиболее распространены среди взрослых особей ApoE
— / — мышей (6), было подтверждено у мышей WT (рис. 5).
А ). Напротив, мы не смогли обнаружить клетки AdvSca1 в корне аорты в Shh
— / — эмбрионов (рис.5
В ). Небольшое количество клеток AdvSca1 было обнаружено в поперечном отделе грудной аорты (рис. 5).
E и F ). Описано отсутствие перегородки общего артериального ствола у Shh-дефицитных эмбрионов (35). Клетки AdvSca1 присутствовали в нисходящей грудной аорте Shh .
— / — эмбрионов, но всегда в уменьшенном количестве (рис. 5
C – F и рис.S5). Присутствие остаточных клеток AdvSca1 указывает на то, что факторы, отличные от Shh, участвуют в хоминге и / или поддержании этих клеток. Поскольку экспрессия Dhh была обнаружена в аорте, низкие уровни Dhh могут позволить некоторым из этих клеток избежать потребности в Shh в стенке артерии.
Инжир.5.
ячеек AdvSca1 в Shh
— / — артерий. ( A – D ) Ткани аорты от WT ( A и C ) и Shh
— / — ( B и D ) эмбрионов на E18.5. Поперечные срезы корня аорты ( A и B ) и нисходящей аорты ( C и D ) иммуноокрашивали на Sca1 (красный), SMαActin (зеленый) и DAPI (синий).( E ) Сплошные линии в указывают взаимное расположение секций в A – D . ( F ) Прямоугольники с пунктирной линией в A – D соответствуют показанным здесь сегментам аорты. Клетки AdvSca1 отсутствуют в корне аорты, значительно уменьшены в восходящей и поперечной аорте (так называемые восходящие) и уменьшены в нисходящей аорте Shh
— / — эмбрионов.
Обсуждение
Мы сообщаем о характеристике сигнального домена Shh в адвентициальном слое стенки сосуда.Этот домен сильно положителен как по активности Ptc1 lacZ , так и по активности Ptc2 lacZ и колокализуется с кольцом белка Shh, размещенным между средой и адвентицией. В этот домен встроена популяция Sca1-экспрессирующих сосудистых клеток-предшественников, называемых клетками AdvSca1, которые могут дифференцироваться в SMC-подобные клетки ex vivo . Количество клеток AdvSca1 в корне аорты значительно уменьшено у Shh
— / — мышей на E18.5. Эти находки подтверждают, что передача сигналов Shh может играть важную роль в развитии адвентиции и поддержании резидентной популяции Sca1 + клеток-предшественников сосудов в стенке артерии.
Hh Сигнализация в стенке послеродовой артерии.
Активность в адвентиции крупных и средних артерий была наибольшей в период между 1 и 10 днями после рождения.Хотя основная структура основных артерий устанавливается при рождении, существенный рост и реконструкция происходят в перинатальном периоде. Например, количество SMC в аорте крысы увеличивается в 2,5 раза, толщина стенки удваивается, а содержание коллагена и эластина увеличивается более чем в 3 раза в первый месяц после рождения (36). Эти изменения в структуре стенки являются адаптацией к значительному перинатальному увеличению кровотока и артериального давления, которое сопровождается соответствующим увеличением сократительной белковой массы гладких мышц (37).После 3-месячного возраста рост стенки артерии уменьшается, скорость пролиферации клеток низкая, а структура стенки достигла взрослого состояния. Мы обнаружили, что активность Ptc lacZ и уровни белка Shh поддерживаются на низком уровне в артериях взрослых мышей, предполагая, что адвентициальная сигнальная активность Shh коррелирует с быстрым постнатальным ростом и ремоделированием стенки артерии.
Распространение Shh в Адвентиции.
Активности Ptc1 lacZ и Ptc2 lacZ были совместно локализованы с белком Shh, депонированным между средой и адвентицией.Движение белков Hh во внеклеточном пространстве ограничивается ковалентными модификациями липидов как на амино-, так и на карбоксиконцевых доменах (38, 39). Модифицированные липидами белки Hh секретируются в виде мультимеров, которые взаимодействуют с гепарансульфатными протеогликанами (HSPG), что дополнительно ограничивает их перемещение (40, 41). Наши данные предполагают, что белок Shh концентрируется между средой и адвентицией из-за локального синтеза, секреции и удержания мультимеров Shh компонентами ВКМ, такими как перлекан HSPG (42), в стенке артерии. Ptc lacZ -положительные клетки располагаются по всей адвентиции, либо непосредственно прилегают к белку Shh на границе медиа-адвентиции, либо на нескольких удаленных клеточных слоях. Мы еще не знаем, является ли этот паттерн активности Ptc lacZ in vivo результатом паракринной секреции Shh самими клетками AdvSca1, удержания Shh в ЕСМ из другого источника или их комбинации. Однако свежевыделенный AdvSca1 содержит легко обнаруживаемые количества мРНК Shh, указывая тем самым, что локальный синтез и секреция Shh является нормальной функцией адвентиции артерий.
Анализ изолированных клеток AdvSca1.
Встроенный в Ptc lacZ -положительный адвентициальный домен, мы обнаружили популяцию Sca1-экспрессирующих клеток, которые были отрицательными для маркерных белков дифференцированных SMC. Однако при удалении из адвентиции и помещении в среду, содержащую сыворотку, значительная часть (≈30–50%) этих клеток потеряла Sca1 с поверхности клетки, приобрела хорошо распределенную форму мезенхимальных клеток и экспрессировала маркерные белки SMC SMαActin. , SM22α, кальпонин и SM-MHC через 12–28 дней.Когда клетки AdvSca1 подвергались воздействию BrdU для мечения реплицирующихся клеток, через 7 дней было обнаружено значительное количество двойных положительных клеток Sca1-BrdU, что указывает на самообновление некоторых AdvSca1, в то время как другие дифференцируются в SMC-подобные клетки под действием такие же условия (рис. S3). Эти результаты предполагают, что клетки AdvSca1 представляют собой гетерогенную смесь клеток, которые могут либо самообновляться, либо отвечать на внеклеточные сигналы и дифференцироваться в SMC-подобные клетки in vitro .
Поддержание фенотипа предшественника транскрипционными корепрессорами.
Клетки AdvSca1 не экспрессируют маркерные белки SMC in vivo . Поэтому было интригующим обнаружить, что клетки AdvSca1 содержат транскрипты для SRF и членов семейства миокардинов и были иммунопозитивными в отношении SRF при исследовании сразу после выделения из стенки артерии. Эти факторы транскрипции являются сильными активаторами экспрессии гена SMC (37, 43–45) и необходимы для дифференцировки SMC сосудов in vivo . Тем не менее, SRF также взаимодействует с мощными транскрипционными корепрессорами, и именно конкуренция между коактиваторами и корепрессорами определяет, транскрибируются ли SRF-зависимые гены-мишени (44–48).В самом деле, мы обнаружили, что корепрессоры транскрипции Msx1, Klf4 и FoxO4 также экспрессируются клетками AdvSca1. Msx1 образует тройной комплекс с SRF и миокардином и ингибирует связывание SRF-миокардина с мотивами CArG-бокса в генах-мишенях SMC (32). Klf4 представляет собой белок, содержащий цинковые пальцы, который связывается с GC-богатым элементом (TCE) и ингибирует SRF-зависимую транскрипцию множественных маркерных генов SMC (47). Фактор транскрипции вилки FoxO4 взаимодействует с миокардином и ингибирует его коактиваторную функцию для SRF-зависимой экспрессии гена SMC (49) . Эти результаты напоминают отчет Мацууры et al. (50), показывая, что клетки Sca1 + из сердец взрослых мышей экспрессируют Nkx2-5 и GATA4, два фактора транскрипции, важные для дифференцировки сердечных миоцитов, но они не экспрессируют маркеры дифференцированных клеток миокарда. Клетки Sca1 + , полученные из сердца, дифференцируются в бьющиеся кардиомиоциты при воздействии окситоцина in vitro , что подтверждает их кардиогенный потенциал (50). Эти находки в сердце и стенке артерий предлагают модель, в которой клетки-предшественники Sca1 + в постнатальных тканях специфицируются для определенных клеточных судеб посредством экспрессии факторов транскрипции, которые необходимы для этих судеб.Поддержание фенотипа предшественника SMC может, следовательно, критически зависеть от экспрессии транскрипционных корепрессоров, которые блокируют SRF-зависимую транскрипцию и рекрутируют комплексы ремоделирования хроматина для подавления экспрессии генов.
Происхождение клеток AdvSca1.
Происхождение клеток AdvSca1 неясно. Hu et al. (6) не обнаружил доказательств того, что клетки AdvSca1 возникают из костного мозга. Мы исследовали этот вопрос для аортальных клеток AdvSca1 с использованием трансгенных мышей Wnt1-cre , у которых β-gal постоянно экспрессируется в клетках, происходящих из нервного гребня (34).Клетки AdvSca1, непосредственно прилегающие к Wnt1-cre -положительным SMC аорты, не экспрессировали маркер нервного гребня. Более того, наши исследования динамики развития показали, что клетки AdvSca1 появляются в артериях дуги аорты только между E15.5 и E18.5, намного позже, чем миграция предшественников SMC, происходящих из нервного гребня, в комплекс дуги аорты ≈E9.5. Две другие линии вносят SMCs в аорту и другие крупные сосуды, то есть параксиальная сомитическая мезодерма и вторичное поле сердца (51).Клон-специфичные мыши cre доступны для обоих этих предшественников, чтобы проверить, происходят ли клетки AdvSca1 из любого из этих источников.
Резюме.
Мы охарактеризовали новый домен передачи сигналов Shh в адвентиции артерий и показали, что популяция клеток-предшественников сосудов Sca1 + находится внутри этого домена. Поскольку адвентиция лежит между стенкой сосуда и окружающими тканями, клетки-предшественники внутри адвентиции могут, в принципе, вносить вклад в процессы ремоделирования, восстановления или заболевания либо в стенке сосуда, либо в соседних несосудистых тканях.Поскольку практически все ткани тела содержат кровеносные сосуды, поддержание и судьба адвентициальных клеток-предшественников, описанных здесь и Hu et al. (6) может иметь отношение к широкому спектру нормальных и патогенных процессов. В будущих работах будет изучена роль передачи сигналов Hh в ответах адвентиции на повреждения тканей, вовлекающие как сосуды, так и окружающие несосудистые типы клеток.
Материалы и методы
Используемые животные.
Все протоколы были одобрены Комитетом по уходу и использованию животных в Университете Северной Каролины. Использованные мыши включают Ptc1 lacZ (Ptc tm1Mps ) (26), Ptc2 lacZ (Ptc2 tm1Dgen ; Jackson Laboratories; 005827), Wnt1 cre (Jackson Laboratories; 005827), Wnt1 cre (Джексон tm1; Laboratories; 003318), Rosa26 (52), CD1 (Charles River), 129 / SvEvJ и C57BL / 6J (Jackson Laboratories). Полдень в день вагинальной пробки был обозначен E0.5.
Активность β-Gal на всем теле.
Эмбрионы или ткани фиксировали в свежем 0,2% глютаральдегиде в 0,1 М фосфате натрия, 5 мМ EGTA, 2 мМ MgCl 2 , pH 7,3, в течение 1 ч на льду, трижды промывали промывочным буфером (10 мМ фосфат натрия, 2 мМ MgCl 2 и 0,1% Triton X-100, pH 7,4) в течение 30 мин каждый при комнатной температуре и окрашивали, как описано в
SI Текст
.
Иммунофлуоресцентное окрашивание.
Ткани фиксировали в 4% параформальдегиде (PFA), промывали PBS, насыщали 20% сахарозой для криозащиты, заливали в агар и замораживали в OCT. Криосрезы (12 мкм) фиксировали и окрашивали, как описано в
SI Текст
. Культивируемые клетки фиксировали в 4% PFA в течение 15 мин при комнатной температуре, затем окрашивали, как описано в
SI Текст
. Первичные антитела и методы визуализации описаны в
SI Текст
.
Выделение и культивирование клеток AdvSca1.
Восходящую аорту, дугу аорты и ≈1 см нисходящей аорты отделяли от взрослых мышей и помещали в PBS на льду. Эндотелий удаляли ватной палочкой. Адвентицию рассекали и промывали в HBSS, расщепляли 14 мг / мл коллагеназы типа 2 (Worthington) и 0,75 мг / мл эластазы (Roche) в HBSS в течение 2 ч при 37 ° C с осторожным покачиванием и фильтровали (70 мкм). Клетки в фильтрате осаждали в количестве 300 × г , затем промывали в PBS + 0.5% BSA. Клетки Sca1 + аорты выделяли с использованием иммуномагнитных шариков против Sca1 MicroBeads и системы разделения клеток MACS (Miltenyi). Клетки пропускали через две последовательные колонки для повышения чистоты выделения. Типичная фракция Sca1 + , полученная таким образом, составляет 1–4% от общего числа клеток, при этом 80–95% изолированных клеток, положительных по антигену Sca1, и <1% изолированных клеток, положительных по SMαActin, по результатам иммуноокрашивания. Выделенные клетки Sca1 + культивировали в среде DMEM (Sigma) плюс 10% FBS (HyClone) и 1 × раствор антибиотика / антимикотика (Gibco) при 37 ° C, 5% CO 2 .Клетки высевали в 48-луночные планшеты для тканевых культур из расчета 8 × 10 3 клеток на лунку. Проверяемыми факторами роста были VEGF-A (10 нг / мл; Clonetics) и BMP2 (50 нг / мл, PeproTech).
Анализ ОТ-ПЦР.
Полную клеточную РНК выделяли денатурацией изотиоцианата гуанидиния и экстракцией фенолом / хлороформом, как описано (53). Двухэтапная ОТ-ПЦР выполнялась с помощью набора GeneAmp RNA PCR kit (Applied Biosystems) в соответствии с инструкциями производителя.Последовательности праймеров и условия ПЦР перечислены в таблице S1.
Благодарности
Мы благодарим Да-Чжи Ванга, Фрэнка Конлона и Джима Фабера за полезные обсуждения. Эта работа была выполнена J.N.P. при частичном выполнении требований для получения степени доктора философии по программе генетики и молекулярной биологии Университета Северной Каролины. Эта работа была поддержана грантами Национального института здравоохранения HL-19242 (для M.W.M.), HL-07816 (для C.M.), GM-00851 (для JNP) и HL43174 и HL71993 (для VLB), награда Национальной исследовательской службы F32 HL68484 (для KH), грант Американской кардиологической ассоциации 0715320U (для JNP и MWM) и Центр сердечно-сосудистой биологии Каролины .
Сноски
- ** Кому адресовать корреспонденцию. Эл. Почта: mmajesky {at} med.unc.edu
Вклад авторов: J.N.П. и М.В.М. спланированное исследование; J.N.P., X.R.D., S.-P.W., C.T.M. и K.A.H. проведенное исследование; В.Л.Б. внесены новые реагенты / аналитические инструменты; J.N.P., X.R.D. и M.W.M. проанализированные данные; и J.N.P. и M.W.M. написал газету.
↵
§ Текущий адрес: Департамент молекулярной и клеточной биологии, Медицинский колледж Бейлора, BCM-130, One Baylor Plaza, Хьюстон, Техас 77030.Авторы заявляют об отсутствии конфликта интересов.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/cgi/content/full/0711382105/DCSupplemental.
- © 2008 Национальная академия наук США
Путь ежа — возможная терапевтическая цель для пациентов с раком груди, отрицательным по рецепторам эстрогена
Abstract
Понимание паттернов экспрессии рецептора эстрогена-α (ERα) необходимо для определения терапевтических стратегий для пациентов с раком груди.Прогноз для пациентов с ERα-отрицательным раком молочной железы все еще оставляет желать лучшего. Ранее мы показали, что передача сигналов Hedgehog (Hh) конститутивно активируется при раке груди и что передача сигналов Hh может быть новой терапевтической мишенью. Таким образом, в этом исследовании изучали, может ли передача сигналов Hh использоваться в качестве терапевтической мишени для пациентов с ERα-отрицательным раком молочной железы. Для этой цели использовали три ERα-отрицательные клеточные линии рака молочной железы, в которых экспрессируются молекулы, связанные с путем Hh, такие как лиганд Patched1 и транскрипционный фактор Gli1, в качестве клеток-мишеней.Циклопамин, ингибитор пути Hh, значительно подавлял как пролиферацию клеток, так и способность этих раковых клеток к инвазии. Кроме того, нокдаун Gli1 посредством РНК-интерференции в этих клетках также значительно снижает как пролиферацию клеток, так и способность к инвазии. Поскольку наши предыдущие данные показали конститутивную активацию пути Hh в хирургически резецированных ERα-отрицательных образцах рака молочной железы, путь Hh, особенно Gli1, может быть полезной терапевтической мишенью для пациентов с ERα-отрицательным раком молочной железы.
Эстроген не только является решающим фактором физиологического разрастания и дифференциации нормальной молочной железы, но также считается стимулятором для инициации и развития рака груди. Биологические эффекты эстрогена опосредуются двумя отдельными внутриклеточными рецепторами, рецептором эстрогена-α (ERα) и ERβ. ERα играет важную роль в пролиферации ERα-положительных клеток рака молочной железы (1, 2), статус ERα важен при принятии решения о эндокринной терапии (3), и были разработаны различные антиэстрогенные агенты, такие как тамоксифен.В результате терапевтическая стратегия для пациентов с ERα-положительным раком молочной железы в настоящее время стандартизирована, и их прогноз выживаемости явно улучшился за последнее десятилетие. С другой стороны, для пациентов с резистентным к химиотерапии ERα-негативным раком груди доступно мало эффективных методов лечения (4). Следовательно, необходимы широкие терапевтические цели, эффективные не только для ERα-положительных случаев, но и для ERα-отрицательных случаев. Недавно мы исследовали новую терапевтическую мишень — путь Hedgehog (Hh) при раке груди (5).
Сигнальный путь Hh является ключевым медиатором многих фундаментальных процессов эмбрионального развития и действует как морфоген, митоген и индуцирующий фактор развивающихся органов (6-8). Путь Hh представляет собой высоко скоординированную и интегрированную сеть, состоящую в основном из белков Hh (Sonic Hh, Indian Hh и Desert Hh), трансмембранного рецептора Patched (Patched1 и Patched2), трансмембранного белка Smoothened (Smo) и фактора транскрипции Gli. гены (Gli1, Gli2 и Gli3) (6-8).В отсутствие Sonic Hh (Shh) Glis образует большой белковый комплекс с другими белками, кинезиноподобным Costal2 и слитой серин-треонинкиназой, и изолируется в цитоплазме (6, 9, 10). В присутствии Shh полноразмерный Glis, высвобождаемый из большого белкового комплекса, транспортируется в ядро для активации генов-мишеней Hh (6, 9, 10). Gli1 — один из генов-мишеней Glis (11). Следовательно, Gli1 является маркером активации пути Hh (9, 12, 13). Доказательства также указывают на то, что правильно регулируемая передача сигналов Hh необходима в некоторых органах взрослых для поддержания стволовых клеток или восстановления тканей (14, 15).В модели на мышах путь Hh играет решающую роль во время развития протока в молочной железе (12), и нарушение генов Patched1 (Ptch2) или Gli2 приводит к серьезным дефектам морфогенеза протоков, таким как гиперплазия протоков, напоминает некоторую гиперплазию у человека (13). Ряд наблюдений показал вклад передачи сигналов Hh в пролиферацию клеток в различных типах раковых клеток (15-19). Считается, что передача сигналов Hh также способствует клеточной инвазии (20, 21).Ранее мы показали, что путь Hh конститутивно активируется в тканях рака молочной железы и что он может быть новой терапевтической мишенью для рака молочной железы, активирующего путь Hh (5). Однако информация о взаимосвязи между активацией пути Hh и статусом ERα отсутствует.
Настоящее исследование сосредоточено на том, может ли путь Hh быть новой терапевтической мишенью против ERα-негативного рака молочной железы, используя лиганд Ptch2 и транскрипционный фактор Gli1 в качестве молекул, связанных с путем Hh.
Материалы и методы
Культура клеток, реагенты и антитела. ERα-отрицательные клеточные линии карциномы молочной железы человека (клетки MDA-MB-231, SK-BR-3, HCC-38) и ERα-положительные клеточные линии карциномы груди человека (MCF-7) (5) были приобретены в American Коллекцию типовых культур (ATCC, Манассас, Вирджиния, США) поддерживали при 37 ° C в увлажненной атмосфере с 5% CO 2 и 95% воздуха в среде RPMI-1640 (Nacalai tesque, Киото, Япония) с добавлением 10% фетальная бычья сыворотка (FBS; Life Technologies Grand Island, NY, США) и антибиотики (100 единиц / мл пенициллина и 100 мкг / мл стрептомицина; Meijiseika, Токио, Япония).Циклопамин, низкомолекулярный антагонист Smo, используемый для блокады передачи сигналов Hh (21-23), был приобретен у Toronto Research Chemicals (Северный Йорк, Онтарио, Канада), разбавлен 99,5% этанолом в качестве исходного раствора и хранился при — 30 ° С.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Суммарную РНК экстрагировали из культивируемых клеток одностадийным методом гуанидиния тиоцианат-фенол-хлороформ. Для реакции обратной транскрипции для прайминга использовали случайный гексамер pd (N) 6 (GE Healthcare UK Ltd, Бакингемшир, Великобритания). Gli1 прямой (5′-TCT GCC CCC ATT GCC CAC TTG-3 ‘) и обратный (5′-TAC ATA GCC CCC AGC CCA CTT G-3’) праймеры дали продукт длиной 480 п.н. Ptch2 прямой (5′-CGG CGT TCT CAA TGG GCT GGT TTT-3 ‘) и обратный (5′-GTG GGG CTG CTG TCT CGG GTT CG-3’) праймеры дали продукт длиной 376 п.н. Глицеральдегид-3-фосфатдегидрогеназа ( GAPDH ) прямой (5′-CCA CCC ATG GCA AAT TCC ATG GCA-3 ‘) и обратный (5′-TCT AGA CGG CAG GTC AGG TCC ACC-3’) праймеры дали начало продукт длиной 593 п.н.Условия амплификации включали начальную денатурацию в течение 2 минут при 95 ° C, затем 30 циклов при 94 ° C в течение 30 секунд, 58 ° C в течение 30 секунд и 72 ° C в течение 1 минуты. Амплификация каждого гена находилась в линейном диапазоне. Продукты ОТ-ПЦР разделяли на 2% агарозных гелях, окрашенных бромидом этидия. Полуколичественный анализ выполняли с помощью Molecular Imager FX Pro (Bio-Rad Laboratories, Геркулес, Калифорния, США).
ПЦР с обратной транскрипцией в реальном времени. Суммарную РНК экстрагировали с помощью набора RNeasy Mini Kit (Qiagen, Валенсия, Калифорния, США) и количественно оценивали спектрофотометрией (Ultrospec 2100 Pro; Amersham Pharmacia Biotech, Кембридж, Великобритания).РНК (700 нг) обрабатывали ДНКазой и обратно транскрибировали в кДНК с помощью набора для обратной транскрипции Quantitect (Qiagen) в соответствии с протоколом производителя. Реакции проводили с SYBR Premix Ex Taq (Takara Bio. Inc., Оцу, Япония) на системе DNA Engine Opticon 2 (MJ Research, Уолтем, Массачусетс, США). Стандартные кривые для 18S рибосомной РНК ( 18S ) были построены с использованием кДНК Gli1 , трансфицированных MK-1, клеток линии клеток рака желудка, установленных в нашей лаборатории.Каждый образец анализировали в трех экземплярах. Все амплифицированные фрагменты имели длину менее 200 п.н. Последовательности использованного праймера: 18S , прямой, 5′-GAT ATG CTC ATG TGG TGT TG-3 ‘, обратный, 5′-AAT CTT CTT CAG TCG CTC CA-3’; Gli1 , прямой, 5′-CTC GGG CAC CAT CCA TTT CTA C-3 ‘, обратный, 5′-ATT GCC AGT CAT TTC CAC ACC A-3’. Количество каждого целевого гена в данном образце было нормализовано до уровня 18S в этом образце.
Иммуноокрашивание клеточных линий. Клетки SK-BR-3, MDA-MB-231, HCC-38 и MCF-7 (2 × 10 4 / лунку) высевали на предварительно уложенные стеклянные покровные стекла, покрытые поли-L-лизином (Asahi Techno Glass Corporation, Chiba, Japan) в 24-луночных планшетах и инкубировали в течение ночи в 10% FBS-RPMI.Клетки фиксировали в 4% параформальдегиде с последующей пермеабилизацией 0,2% Triton® X-100 и затем инкубировали с первичным антителом, а затем с вторичным антителом. Клетки контрастировали 4 ‘, 6-диамидино-2-фенилиндолом (DAPI; Sigma-Aldrich Corp., Сент-Луис, Миссури, США). После закрепления в среде Vectorshield Mounting Medium (Vector Laboratories, Burlingame, CA, USA) образцы исследовали с помощью флуоресцентной микроскопии (Axioimager A1; Carl Zeiss Imaging, Токио, Япония). Время экспозиции для записи было вручную зафиксировано на 12 мс, 25 мс и 3 мс для Ptch2, Gli1, и DAPI соответственно.Используемые антитела и разведения были следующими: кроличьи анти-Ptc в соотношении 1: 100, козьи анти-Gli в соотношении 1: 100, куриные анти-кроличьи IgG AlexaFluor 488 в соотношении 1: 1000 (Molecular Probes, Юджин, Орегон, США) и AlexaFluor 594 ослиный анти-козий IgG в концентрации 1: 1000 (молекулярные зонды).
Малая интерферирующая РНК (миРНК) против Gli1. Клетки SK-BR-3 (5,0 × 10 5 ) и клетки MDA-MB-231 (5,0 × 10 5 ) трансфицировали миРНК (100 нМ) против Gli1 (ON-TARGET плюс SMART). пул, L-003896) и миРНК отрицательного контроля (ON-TARGET плюс siCONTROL Non-targeting Pool, D-001810), приобретенные у Dharmacon RNA Technologies (Чикаго, Иллинойс, США) путем нуклеофекции с Nucleofector II (Amaxa GmbH, Кельн, Германия ) в соответствии с инструкциями производителя и помещали в колбу размером 25 см 2 на 48 часов в 10% FBS-RPMI, а затем использовали для ОТ-ПЦР в реальном времени, анализа пролиферации и анализа инвазии.
Анализ инвазии матригеля. Инвазивность клеток рака груди оценивалась на основании инвазии клеток через вставки трансвелл, покрытые матригелем. Вкратце, верхняя поверхность фильтра (размер пор 8,0 мкм; BD Biosciences, Гейдельберг, Германия) была покрыта базальной мембраной Matrigel (BD Biosciences) в концентрации 2 мг / мл и инкубирована при 4 ° C в течение 3 дней. час; несвязанный материал был аспирирован. Клетки суспендировали в RPMI-1640 с 10% FBS, содержащим желаемую дозу реагентов.Затем клетки SK-BR-3 (1,0 × 10 5 ) и клетки MDA-MB-231 (3,0 × 10 4 ) добавляли в верхнюю камеру и инкубировали в водонасыщенной атмосфере с 5% CO 2 . при 37 ° C в течение 16 ч. После инкубации фильтр фиксировали 70% этанолом и окрашивали реагентом Diff-Quik (International Reagents, Кобе, Япония). Затем клетки на верхней поверхности полностью удаляли, протирая ватным тампоном. Клетки, которые мигрировали из верхней части фильтра в нижнюю, подсчитывали под световым микроскопом (BX50; Olympus Corp., Токио, Япония) при увеличении × 100. Инвазивность опухолевых клеток определяли как общее количество клеток в пяти случайно выбранных микроскопических полях. Каждый эксперимент проводили в трех лунках.
Фигура 1.
Экспрессия компонентов пути Hh в клетках рака груди человека. A, экспрессия мРНК Gli1 и Ptch2 в клетках SK-BR-3, MDA-MB-231, HCC-38 и MCF-7. B, иммунофлуоресцентное окрашивание антителами против белков Gli1 (красный сигнал) и Ptch2 (зеленый сигнал). Синий сигнал представляет собой окрашивание ядерной ДНК с помощью DAPI.Ab, первичные Ab (-), без добавления первичных антител.
Анализ пролиферации. SK-BR-3 (5 × 10 3 / лунка), MDA-MB-231 (3 × 10 3 / лунка) и HCC-38 (5 × 10 3 / лунку) были засеяны в 96-луночные планшеты в полной культуральной среде и инкубировали в течение ночи. Среду заменили на 5% FBS, содержащую указанные дозы циклопамина. После 72 ч инкубации пролиферацию клеток оценивали с помощью анализа 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолийбромида (МТТ).Каждый эксперимент проводили в трех повторностях.
Клинические образцы. Десять пациентов с первичной карциномой молочной железы подверглись резекции в отделении хирургии и онкологии Университета Кюсю (Фукуока, Япония) в период с апреля 2004 г. по август 2006 г. Все десять пациентов дали информированное согласие перед хирургическим лечением и были включены в настоящее исследование. Все опухоли и нормальные ткани были заморожены при -80 ° C, исследованы гистопатологически и классифицированы с использованием классификации опухолевых узлов и метастазов.Общая мРНК этих образцов была извлечена с использованием мини-набора RNeasy (Qiagen) в соответствии с рекомендациями производителя. Стандартная кривая для β-тубулина была построена с использованием кДНК Gli1 — трансфицированных клеток MK-1. Каждый образец анализировали в трех экземплярах. Все амплифицированные фрагменты имели длину менее 200 п.н. Последовательности используемых праймеров: β-тубулин , прямой, 5′-CCG TGT CTG ACA CCT TGG GT-3 ‘, обратный, 5′-ATC AGC AAG ATC CGG GAA GAG-3’ и Gli1 , вперед , 5′-CTC GGG CAC CAT CCA TTT CTA C-3 ‘, обратный, 5′-ATT GCC AGT CAT TTC CAC ACC A-3’.Количество каждого целевого гена в данном образце было нормализовано до уровня β-тубулина в этом образце.
Статистический анализ. Тест Стьюдента t использовали для статистического анализа, если не указано иное. Для клинических образцов использовался тест Wilcoxon t . Все расчеты проводились с помощью программного обеспечения StatView 5.0 J (Abacus Concepts, Беркли, Калифорния, США). Звездочка означает p <0,05 и p — значения меньше 0.05 считались значительными.
Результаты
Экспрессия молекул, связанных с путем Hh, в ERα-отрицательных клетках рака молочной железы. Было подтверждено, что клетки MDA-MB-231, SK-BR-3 и HCC-38 не экспрессировали ERα (рис. 1A), и все эти ERα-отрицательные клеточные линии экспрессировали Ptch2 и Gli1 на обеих мРНК (рис. 1A). ) и уровни белка (рис. 1B).
Эффект блокады передачи сигналов Hh на пролиферацию ERα-отрицательных клеток рака молочной железы. Когда раковые клетки культивировали с циклопамином в различных концентрациях (от 1 до 100 мкМ) в течение 6 часов, концентрации циклопамина более 10 мкМ значительно подавляли экспрессию мРНК Gli1 во всех ERα-отрицательных клетках рака молочной железы по сравнению с носителем этанола 10 мкМ. (Рисунок 2A).Когда эти клетки культивировали с циклопамином в течение 72 часов, циклопамин подавлял пролиферацию клеток дозозависимым образом (рис. 2В). Однако, когда клетки культивировали с циклопамином (от 1 до 100 мкМ) в течение 24 часов, циклопамин не влиял на пролиферацию клеток (данные не показаны).
Чтобы подтвердить вклад передачи сигналов Hh в пролиферацию ERα-отрицательных клеток рака молочной железы, Gli1 подавлялся посредством РНК-интерференции. Трансфекция миРНК
нацеливание на Gli1 привело к 90% -ному снижению экспрессии мРНК Gli1 в клетках SK-BR-3 и MDA-MB-231 по сравнению с контрольной миРНК (рис. 3A), а нокдаун Gli1 привел к значительному подавлению пролиферации по сравнению с контролем (рис. 3B).
Таблица I.
Клинико-патологические особенности 10 ER-отрицательных образцов.
Блокада передачи сигналов Hh и инвазивная способность ERα-отрицательных клеток рака молочной железы. Когда клетки SK-BR-3 или клетки MDA-MB-231 инкубировали с циклопамином в течение 16 часов, циклопамин уменьшал способность к инвазии дозозависимым образом (рис. 4A). Чтобы подтвердить вклад передачи сигналов Hh в инвазию ERα-отрицательных клеток рака молочной железы, Gli1 подавлялся посредством РНК-интерференции.Нокдаун Gli1 значительно снижает инвазионную способность по сравнению с контрольными клетками, трансфицированными siRNA (фиг. 4B).
Экспрессия мРНК Gli1 в ERα-негативных тканях рака молочной железы человека. Анализ ОТ-ПЦР в реальном времени использовали для количественного анализа экспрессии мРНК Gli1 . Клинико-патологические особенности 10 ER-отрицательных образцов показаны в таблице I. Уровень экспрессии мРНК Gli1 в ERα-отрицательных тканях рака молочной железы был значительно выше, чем в нормальных тканях (фиг. 5).
Обсуждение
Впервые было показано, что передача сигналов Hh вносит вклад не только в пролиферацию, но и в инвазию в ERα-отрицательные клетки рака молочной железы. Это открытие указывает на то, что передача сигналов Hh может быть полезной в качестве терапевтической мишени для пациентов с ERα-отрицательным раком молочной железы.
Фигура 2.
Влияние циклопамина на экспрессию мРНК Gli1 и пролиферацию клеток. A, экспрессия мРНК Gli1 в ERα-отрицательных клетках рака молочной железы после обработки этанолом-носителем или циклопамином (Cyc) в течение 6 часов.Среднее ± стандартное отклонение, * p <0,05. B, ERα-отрицательная пролиферация клеток рака молочной железы после обработки 100 мкМ этанола-носителя или различных концентраций (от 1 до 100 мкМ) циклопамина при 37 ° C в течение 72 часов. После инкубации жизнеспособность клеток измеряли с помощью анализа МТТ при поглощении при 570 нм. Среднее ± стандартное отклонение. * р <0,05.
Рисунок 3.
Влияние siRNA Gli1 на пролиферацию ERα-отрицательных клеток рака молочной железы. А, экспрессия мРНК; B, пролиферация клеток. Клетки выдерживали при 37 ° C в течение 72 часов. Жизнеспособность клеток измеряли с помощью анализа МТТ, детектируемого при оптической плотности при 570 нм.Среднее ± стандартное отклонение, * p <0,05.
Важно отметить, что путь Hh активирован в большинстве из 52 образцов рака молочной железы, исследованных в нашем предыдущем исследовании, и что циклопамин может подавлять пролиферацию нескольких клеточных линий рака молочной железы (5). Эти данные свидетельствуют о том, что путь Hh может активироваться независимо от статуса экспрессии ERα. В этом случае циклопамин может подавлять распространение ERα-отрицательного рака молочной железы (5). Чтобы изучить эту возможность, мы повторно проанализировали наши предыдущие данные в деталях относительно взаимосвязи между передачей сигналов Hh и состоянием экспрессии ERα.Как мы и ожидали, этот анализ показал, что путь Hh был конститутивно активирован во всех 13 ERα-отрицательных образцах рака молочной железы, как и в трех ERα-отрицательных клеточных линиях рака молочной железы, исследованных в настоящем исследовании, как показано Gli1 выражение (рисунок 1). Однако было обнаружено, что степень активации передачи сигналов Hh была значительно выше в 39 ERα-положительных образцах рака молочной железы, чем в 13 ERα-отрицательных образцах рака молочной железы, когда ядерная транслокация Gli1 использовалась в качестве маркера активации Hh-пути. (5).Циклопамин подавлял пролиферацию трех ERα-отрицательных клеточных линий рака молочной железы в настоящем исследовании (рис. 2В). Поскольку циклопамин может быть неточно специфичным в отношении передачи сигналов Hh, чтобы подтвердить вклад передачи сигналов Hh в пролиферацию клеток, мы заглушили Gli1 , который является транскрипционным фактором и сам по себе является мишенью транскрипции передачи сигналов Hh в ERα-отрицательной груди. раковые клетки. Нокдаун Gli1 также индуцировал значительное подавление пролиферации в ERα-отрицательных клетках рака молочной железы (фиг. 3B).
Рисунок 4.
Влияние циклопамина и миРНК Gli1 на инвазию ERα-отрицательных клеток рака молочной железы. Инвазия клеток MDA-MB-231 и SK-BR-3, A, после инкубации с циклопамином или без него (Cyc; B, после контроля или трансфекции siRNA. Клетки поддерживали при 37 ° C в течение 16 часов при увеличении × 40. Среднее значение ± sd, * p <0,05. Миграционную способность клеток рака молочной железы оценивали так же, как описано выше, за исключением использования вставок трансвелл, не покрытых матригелем.
Рисунок 5.Экспрессия мРНК
Gli1 в хирургически удаленных тканях рака молочной железы. Парные белые кружки обозначают относительную экспрессию мРНК Gli1 в нормальных или раковых тканях одного и того же образца. Эти данные были нормализованы к соответствующей экспрессии мРНК β-тубулина.
Также был продемонстрирован вклад передачи сигналов Hh в инвазивность ERα-отрицательных клеток рака молочной железы (Рисунок 4). Недавно была продемонстрирована ассоциация клеточной инвазии с передачей сигналов Hh в клетках рака поджелудочной железы (20, 21).Фактически, наше предыдущее исследование показало положительную взаимосвязь между инвазивной способностью и степенью активации передачи сигналов Hh, поскольку степень активации передачи сигналов Hh у инвазивных карцином протокового типа была выше, чем у неинвазивных карцином протокового типа (5). Хотя молекулярный механизм остается неясным, наши недавние данные свидетельствуют об участии повышенной экспрессии матричной металлопротеиназы (MMP) -9, опосредованной Hh-путем, в повышенной инвазивной способности клеток рака поджелудочной железы человека (21).
В заключение, блокада передачи сигналов Hh полезна для лечения пациентов с ERα-негативным раком молочной железы, что подтверждается нашими предыдущими данными, показывающими частую активацию передачи сигналов Hh в ERα-негативных образцах рака молочной железы.











 Стебли можно сделать из проволоки и изогнуть их причудливым образом.
Стебли можно сделать из проволоки и изогнуть их причудливым образом.
 Сворачивают полукруг трапецией («стаканчиком») и отгибают уголки в стороны. С изнаночной стороны можно закрепить завязки из ленточек.
Сворачивают полукруг трапецией («стаканчиком») и отгибают уголки в стороны. С изнаночной стороны можно закрепить завязки из ленточек. Необходимо вначале приклеить три лепестка. Каждый лепесток нужно хорошо прижать у основания и подержать 5 с.
Необходимо вначале приклеить три лепестка. Каждый лепесток нужно хорошо прижать у основания и подержать 5 с.


